氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度(g/100gH2O)如下:
| 温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
| NH4Cl溶解度 |
33.3 |
37.2 |
41.4 |
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有  。
。
(2)上述流程中发生两步反应,化学方程式为 ,
。
(3)操作II的作用是 ,
操作Ⅲ的具体过程是 。
(4)流程中NH4HCO3必须过量,其原因是
_______________________________________________________________________。
实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。某研究性学习小组发现一瓶未密闭的NaOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含NaOH;
假设2:含NaOH和Na2CO3;
假设3:只含Na2CO3
(1)成分中可能含有Na2CO3的原因是(用化学方程式回答) 。
(2)取少量样品于试管中,加入足量稀盐酸,观察到________________,说明假设2或假设3成立。
(3)进一步探究的过程如下: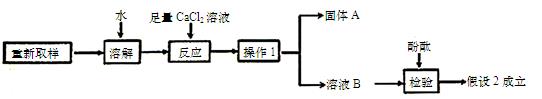
①“操作1”的名称是 ,
②“固体A”的化学式是___________。
③加入足量CaCl2溶液的作用是 。
④溶液B中滴加酚酞后,观察到 ,说明假设2成立。
如图是初中化学中常见的物质之间的转换关系,其中A为常用的食品干燥剂,C为白色沉淀,D为蓝色沉淀,E为红色的固体单质。请你回答问题: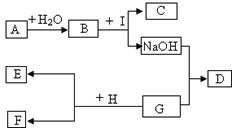
(1)写出物质的化学式:A D
(2)写出反应的化学方程式:
B和I 。基本反应类型是 。
G和H 。基本反应类型是 。
反应现象是 。
(3)这些物质间的反应,没有涉及到的基本反应类型是 。请你用图中的物质写一个符合该基本反应类型的化学方程式 。
现欲探究一固体混合物A的成分,已知其中可能含有BaCl2、Na2CO3、NH4Cl、CuO四种物质中的两种或多种。按图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。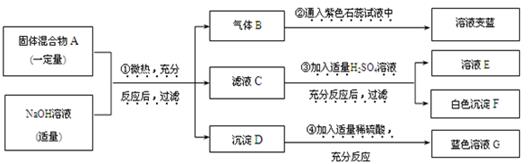
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)气体 B 的化学式为_______ ____。
(2)滤液 E 中大量存在的阳离子为(写离子符号)_______ ____。
(3)混合物 A 中,肯定不存在的物质是(写化学式)________,理由是_________。
(4)写出实验过程④中发生反应的化学方程式:__________________。
某兴趣小组在实验室发现了一块绿色的孔雀石标本,查阅资料知其主要成分是Cu2(OH)2 CO3。他们以Cu2(OH)2 CO3原料制取铜,其工艺流程如下图所示: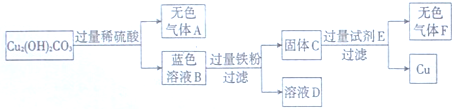
(1)过滤操作中用到的铁制仪器为 。玻璃棒的作用是搅拌和 。
(2)无色气体A的化学式是 ,大气中该气体含量不断上升,会导致 增强,全球气候变暖。
(3)写出蓝色溶液B与铁粉反应的化学方程式 。
(4)试剂E可选用 溶液。写出固体C与试剂E反应的化学方程式 。
下图是实验室制取气体的装置图(固定装置省略),请回答下列问题:
(1)仪器名称:a ,b 。
(2)B图的装置可用来制取一种具有助燃性的气体,写出制取该气体的化学方程式: ,该装置操作上的优点是 。
D装置操作上的优点是 。
(3)写出实验室用高锰酸钾制取氧气的化学方程式 ,若用E收集一瓶干燥的氧气,其中Ⅰ瓶中盛放的试剂是 (填名称),并将图E补充完整。
(4)实验室用锌粒与稀硫酸反应制取氢气,发生装置如图所示。打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是_________(填字母)。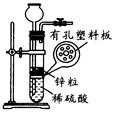
| A.氢氧化钠溶液 | B.碳酸钠溶液 |
| C.硫酸钠溶液 | D.澄清石灰水 |