 高铁电池的总反应为:
高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述错误的是( )
| A.放电时每转移6mol电子,负极有2mol K2FeO4被还原 |
| B.充电时阴极反应为:Zn(OH)2 + 2e— = Zn+ 2OH— |
C.放电时正极反应为:FeO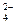 + 3e— + 4H2O = Fe(OH)3 + 5OH— + 3e— + 4H2O = Fe(OH)3 + 5OH— |
| D.充电时Zn电极与外电源的负极相连 |
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
① HUr + H2O  Ur- + H3O+②Ur- (aq)+Na+(aq)
Ur- + H3O+②Ur- (aq)+Na+(aq)  NaUr(s)
NaUr(s)
(尿酸) (尿酸根离子)
下列对反应②叙述中正确的是( )
| A.反应的△H>0 | B.反应的△H<0 |
| C.升高温度平衡向正反应方向移动 | D.改变温度不影响平衡移动 |
在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v逆>v正 |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
乙酸蒸气能形成二聚分子2CH3COOH(g)  (CH3COOH)2 (g) Δ H<0 ,欲测定单体乙酸的相对分子质量,应采用的条件是()
(CH3COOH)2 (g) Δ H<0 ,欲测定单体乙酸的相对分子质量,应采用的条件是()
| A.高温低压 | B.低温高压 | C.低温低压 | D.高温高压 |
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
| A.-1 780 kJ/mol | B.-1 220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )
| A.ΔH<0 ΔS>0 | B.ΔH>0 ΔS<0 |
| C.ΔH>0 ΔS>0 | D.ΔH<0 ΔS<0 |