W、X、Y、Z是原子序数依次增大的同一周期元素,原子序数均小于18,W、X是金属元素,Y、Z是非金属元素。
(1)已知:W、X各自的氧化物对应的水化物可以反应生成盐和水,写出X的氧化物与过量氢氧化钠溶液反应的离子方程式 。
(2)W与Y可形成化合物W2Y,该化合物水溶液呈碱性,用离子方程式解释其原因:
。
(3)Y的某氧化物通入Z单质的水溶液中,发生反应生成两种强酸的化学方程式为:
。
(4)写出Z-离子的核外电子排布式: 。
(5)W、X、Y、Z四种元素简单离子的半径由小到大的顺序是
< < < (写离子符号)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下: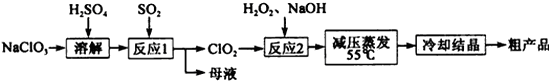
(1)提高“反应1”反应速率的措施有。(回答一点即可)
(2)“反应1” 的离子方程式是。
(3)“反应2”的氧化剂是,该反应的化学方程式为。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。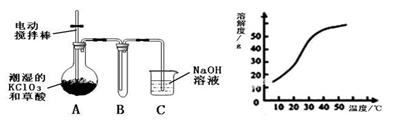
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;②;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为:;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。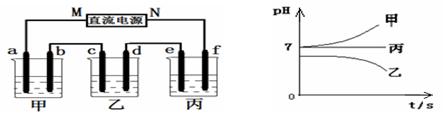
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式;
(2)电极f上发生的电极反应为;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是。
卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: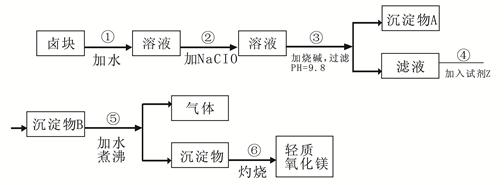
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
表2化学试剂价格表
| 试剂 |
价格(元/吨) |
| 漂液(含NaClO,25.2%) |
450 |
| 双氧水(含H2O2 ,30%) |
2400 |
| 烧碱(含98% NaOH) |
2100 |
| 纯碱(含99.5% Na2CO3) |
600 |
(1)在步骤②中加入漂液而不是双氧水其原因是。
写出加入NaClO发生反应的离子方程式。
(2)在步骤③中控制pH=9.8,其目的是。
(3)沉淀物A的成分为,试剂Z应该是。
(4)在步骤⑤中发生反应的化学方程式是。
(5)若在实验室中完成步骤⑥,则沉淀物必需在(填仪器名称)中灼烧。
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3 (l)+ H2O (l)+ CO2 (g) (NH4)2CO3 (aq)△H1
(NH4)2CO3 (aq)△H1
反应Ⅱ:NH3 (l)+ H2O (l)+ CO2 (g) NH4HCO3 (aq)△H2
NH4HCO3 (aq)△H2
反应Ⅲ:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g) 2NH4HCO3 (aq)△H3
2NH4HCO3 (aq)△H3
请回答下列问题:
(1)△H1与△H2、△H3之间的关系是:△H3= 。
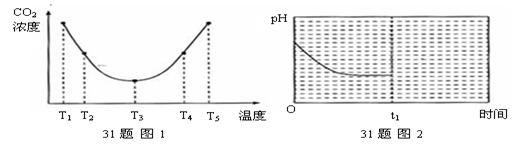
(2)为研究温度对(NH4)2CO3捕获CO2气体效率的影响,在温度为T1、T2、T3、T4、T5的条件下,将等体积等浓度的(NH4)2CO3溶液分别置于等体积的密闭容器中,并充入等量的CO2气体,经过相同时间测得容器中CO2气体的浓度,得趋势图(下图1)。则:
①△H3______0 (填“>”、“=”或“<”)。
②温度高于T3,不利于CO2的捕获,原因是 。
③反应Ⅲ在温度为K1时,溶液pH随时间变化的趋势曲线如下图2所示。当时间到达t1时,将该反应体系温度迅速上升到K2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化趋势曲线。
|
在250℃时,吲哚与乙醇酸在碱的存在下反应,可以得到植物生长素吲哚乙酸:
由邻硝基甲苯1和草酸二乙酯2反应最终可合成吲哚5(Et表示CH3CH2—):
乙醇酸的合成: 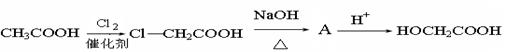
(1)物质4的分子式是,吲哚乙酸的含氧官能团的名称是;
(2)邻硝基甲苯与草酸二乙酯反应除生成物质3外,还有另外一种有机物是,
该反应的反应类型是;
(3)生成物质A的化学方程式是;
(4)已知乳酸的结构简式为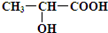 ,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):;
,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):;
(5)邻硝基甲苯苯环上含有氨基的同分异构体有多种,请写出其中一种的结构简式。