A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。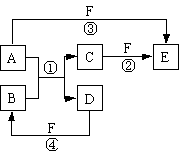
(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,反应后溶液呈浅绿色。则反应②(在水溶液中进行)的离子方程式是 ;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
(2)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A的分子构型为 ,C的结构式是 。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,,反应④的化学方程式是 。
(4)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是 。
(1)通过实验事实的验证与讨论,认识苯的结构式。提出问题:苯分子结构是碳碳单双键交替的环状结构吗?
①提出假设:从苯的分子式看,C6H6具有不饱和性;从苯的凯库勒结构式看,分子中含有碳碳双键,但实验验证:苯不能使褪色;
②经科学测定,苯分子里6个碳原子之间的键(相同或不同);6个碳原子和6个氢原子都在同一平面上。
③应用:为了表示苯分子的结构特点,可用来表示苯分子的结构式,而凯库勒式表示苯分子结构式是不确切的,只是人们沿用至今。
(2)乙醇的分子式,电子式,结构简式,官能团为,官能团名称是
可以用来鉴别甲烷和乙烯, 又可以用来除去甲烷中混有的少量乙烯的操作方法是
| A.混合气通过盛酸性高锰酸钾溶液的洗气瓶 |
| B.混合气通过盛足量溴水的洗气瓶 |
| C.混合气通过盛水的洗气瓶 |
| D.混合气跟氯化氢混合 |
已知卤代烃(R-X)在碱性条件下可水解得到醇(R-OH),如:CH3CH2-X+H2O 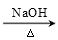 CH3CH2-OH+HR,现有如下转化关系:
CH3CH2-OH+HR,现有如下转化关系: 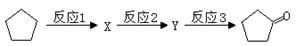
回答下列问题:
(1)反应1的试剂与条件为 __________,X的结构简式为______,Y的结构简式为______;
(2)写出反应3的方程式___________________________________。
某有机物的结构简式为: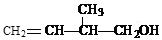
(1)该有机物中所含官能团的名称是_______________________________________;
(2)该有机物发生加聚反应后,所得产物的结构简式为_______________________;
(3)写出该有机物发生催化氧化的化学方程式(注明反应条件)_______________。
已知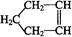 可简写为
可简写为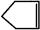 。降冰片烯的分子结构可表示为:
。降冰片烯的分子结构可表示为: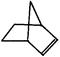
(1)降冰片烯属于__________。A.环烃 B.不饱和烃 C.烷烃 D.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为 _________。
(4)降冰片烯不具有的性质__________。
A.能溶于水 B.能发生氧化反应 C.能发生加成反应 D.常温常压下为气体25.