组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有______(写元素符号),它的原子最外层共有______种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置_______________________。
(2)糖类是人体获得能量的来源之一。已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式_______________________________________。
(3)CO2是一种温室气体,它的电子式为______________,将其转变其他化工原料,必须破坏的化学键属于_________(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是______(填序号)。
a.离子半径:S2—>Na+>O2—>H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原 性:PH3>H2S>HCl>HF
性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 |
H-H |
H-F |
H-Cl |
H-Br |
H-O |
H-S |
H-N |
H-P |
| 键长(pm) |
74 |
92 |
127 |
141 |
98 |
135 |
101 |
321 |
| 键能(kJ/mol) |
436 |
568 |
432 |
368 |
464 |
364 |
391 |
142 |
根据表中数据,归纳共价键键能与键长的关系_______________________________________。
应用化学学科知识,回答下列问题
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)△H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)△H = -566.0 kJ/mol
H2O(g)=H2O(1)△H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ________。
(2)水煤气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H=" +" 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H=" +" 181.6KJ/mol。此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
(3)已知A和B在一定条件下可建立如下平衡:2A(g)+B(g) 2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
2C(g)。在500℃时,分别将2 molA和1molB置于恒压容器Ⅰ和恒容容器Ⅱ中(两容器起始容积都为10L),充分反应。
①达到平衡所需时间是ⅠⅡ(填“>”、“<”或“=”,下同)。达到平衡后,两容器中C的体积分数关系是ⅠⅡ。
②平衡时,测得容器Ⅱ中的压强减小了30%,则该容器中A的转化率为。
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。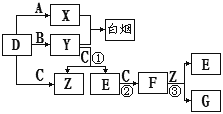
请回答下列问题:
(1)D的化学式为。
(2)写出实验室制Y的化学方程式 。
(3)反应③的离子方程式为。
(4)写出反应①的化学方程式。
(5)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为。
(6)常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为________________________________________________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___。
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下: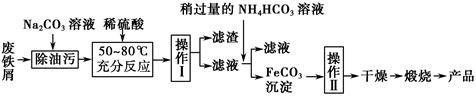
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为_____________________。
②请写出生成FeCO3沉淀的离子方程式:____________________________。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: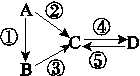
图G52
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:____________________。D的化学式是______。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_______________________________。
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________