用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________、_______________、_______________。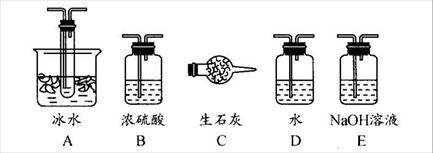
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是 。
(16分)宇航员佩戴头盔的盔壳由聚碳酸酯制成,具有 隔音、隔热、防碰撞、减震性好、质量小等特点。已知:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有很好的反应活性,易跟某些含羰基的化合物R—C O—R′(R、R′代表烷基或H原子)。发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
隔音、隔热、防碰撞、减震性好、质量小等特点。已知:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有很好的反应活性,易跟某些含羰基的化合物R—C O—R′(R、R′代表烷基或H原子)。发生缩合反应生成新的有机物和水。苯酚还能发生如下反应生成有机酸酯: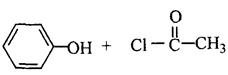
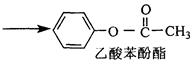 +HCl
+HCl
下图是合成聚碳酸酯的过程(反应条件和部分产物未写出):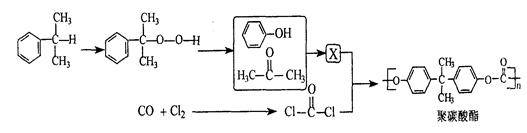
请写出:
(1)X的结构简式。
O
(2)在一定条件下X与Cl—C—Cl 反应合成聚碳酸酯的化学方程式
。
(3)X和浓溴水反应时,1molX最多能消耗Br2 mol。
mol。
(4)与乙酸苯酚酯分子式相同,分子中含有苯环且属于酯的其它可能的结构简式 。
。
某研究性学习小组在实验室合成了一种物质A。 ⑴经分析,A的相对分子质量不超过100,A中C、H的质量分数分别为:w(C)=69.76%,w(H)=11.63%,且完全燃烧后产物只有CO2和H2O。则A的摩尔质量为。
⑴经分析,A的相对分子质量不超过100,A中C、H的质量分数分别为:w(C)=69.76%,w(H)=11.63%,且完全燃烧后产物只有CO2和H2O。则A的摩尔质量为。
⑵该兴趣小组同学对物质A结构进行了预测,其中不正确的是(填序号)
A.可能含有一个碳环和一个醛基 B.可能含有一个碳碳双键和一个羟基
C.可能只含一个碳氧双键官能团 D.可能是环状的醚
⑶若A的核磁共振氢谱如下图所示,且A可以和金属钠反应生成H2,但不能在Cu作催化剂下被催化氧化。(提示:羟基与碳碳双键相连的结构不稳定)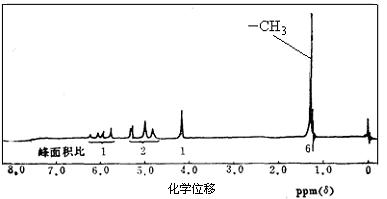
请根据以上信息写出A的结构简式。
⑷A的某种同分异构体B分子中不含支链,能发生银镜反应。写出B发生银镜反应的化
学方程式。
(15分)有机物中,有一些分子式符合通式CnHn,如C2H2、C6H6等。
(1)关于这些有机物的说法中正确的是___________(选填编号)。
| A.可能互为同分异构 |
| B.在空气中燃烧时火焰明亮且产生黑烟 |
| C.一定能使酸性高锰酸钾溶液褪色 |
| D.等质量的这些有机物完全燃烧时耗氧量相同 |
(2)写出分子式为C4H4且为链烃的有机物的结构简式___________________________,它的一氯代物的同分异构体有________种。
(3)写出分子式为C6H6且结构中只有C-C键和C-H键的有机物结构简式:____________________。
(4)某有机物分子式为C8H8,且属于芳香烃,已知它可使酸性高锰酸钾溶液和溴水褪色,则该有机物的结构简式为_________________________,写出其发生加聚反应的化学方程式。
比较甲烷与氯气、乙烯与溴的反应,以及甲烷、乙烯在空气中燃烧的现象,按要求填写下列表格
| 反应物 |
反应类型 |
反应条件 |
生成物(写结构简式) |
现象 |
| 甲烷、氯气 |
① |
④ |
||
| 乙烯、溴 |
② |
⑤ |
||
| 甲烷、氧气 |
③ |
|||
| 乙烯、氧气 |
⑥ |
1)2)
3)4)
5)6)
下表是元素周期表的一部分
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 1 |
||||||||
| 2 |
D |
|||||||
| 3 |
B |
C |
E |
|||||
| 4 |
A |
(1)写出元素符号: B.C、D 、E;
、E;
(2)D-离子结构示意图,B+离子结构示意图,