下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|
|
|||||||||||||||
| |
|
|
|
f |
y |
h |
i |
|
|||||||||
| |
b |
|
e |
|
|
|
j |
|
|||||||||
| c |
|
|
|
|
|
|
d |
[ |
d |
|
g |
|
l |
|
|
|
|
| |
|
|
[ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请写出上述元素d3+的核外电子排布式 ;
(2)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号),其原因是
(3)请写出e元素的原子价电子轨道表示式 ;
(4)ya3分子的电子式是 ,其分子的空间构型是 ,分子中y原子的原子轨道的杂化类型是 , g2+与ya3形成的g[ (ya3)4]2+离子的空间构型是四面体形,其中g2+离子提供4个能量最低的空轨道通过杂化与ya3形成 (填化学键类型)。
现有以下物质:①NaCl晶体 ②液态SO3 ③液态HCl ④汞 ⑤BaSO4固体
⑥纯蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是_____________________________。
(2)以上物质中属于电解质的是_________________________。
用双线桥法标出下列反应的电子转移情况和化合价升降情况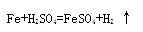
写出下列反应的离子方程式
(1)锌与稀硫酸反应
(2)用石灰石与盐酸反应制取二氧化碳:
酸、碱、盐在水溶液中能导电是因为它们在溶液中发生了,产生能够自由移动的离子。酸是指电离时生成的阳离子全部都是的化合物;碱是指电离时生成的阴离子全部都是的化合物;盐是指电离生成的化合物。
已知2A(g)+B(g)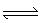 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C )="0.040" mol·L-1,放出热量Q1kJ。
)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是(填写序号);
a.v(C)="2v(B)" b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为(用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K=;
(4)已知:K(300℃)>K(350℃),该反应是(填“放”或“吸”)热反应;若反应温度升高,A的转化率(填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)K(B)(填“>”、“<”或“=”)。