已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C )="0.040" mol·L-1,放出热量Q1kJ。
)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
a.v(C)="2v(B) " b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
分高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: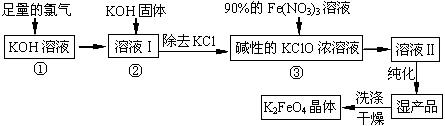
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ + ,完成并配平上述反应的离子方程式。
分现用质量分数为36.5%的浓盐酸(密度为1.19 g/cm3)配制1 mol/L的稀盐酸90 mL。
(1)实验中应选用的仪器是(填序号)____ ____;
①100 mL量筒 ②托盘天平(带砝码) ③玻璃棒 ④50 mL容量瓶
⑤10 mL量筒 ⑥50 mL烧杯 ⑦100 mL容量瓶 ⑧胶头滴管
(2)经计算,需量取浓盐酸的体积为____________mL;
(3)此实验中玻璃棒的作用是_________________________;
(4)某学生实际配制稀盐酸的浓度,经滴定测量为0.98 mol/L,原因可能是下列操作中____ ____。
①取用完浓盐酸的量筒未洗涤
②转移溶液后,小烧杯未洗涤
③定容时俯视容量瓶刻度线
④移液前容量瓶内有少量蒸馏水
⑤定容摇匀后液面下降再加水
⑥定容时仰视容量瓶刻度线
完成以下化学方程式
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2) KMnO4 + HBr= Br2 + MnBr2 + KBr + H2O
完成下列反应的反应方程式:
(1)NaOH溶液吸收氯气的反应:____________________________
(2)铁与水蒸气在高温下的反应: ____________________________
(3)氢氧化铁溶于盐酸:____________________________
(4)铝单质溶解在氢氧化钠溶液中:____________________________
(5)过氧化钠与二氧化碳反应:____________________________
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板_________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为____________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_____ 。
(5)K2FeO4在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O |
| B.稀KOH溶液、异丙醇 |
| C.NH4Cl溶液、异丙醇 |
| D.Fe(NO3)3溶液、异丙醇 |
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。