由以下一些微粒:136C、3919K、4020Ca、126C、147N、4018Ar。其中:互为同位素的是________和________;
质量数相等,但不能互称同位素的是_________和__________;
中子数相等,但质子数不相等的是_________和_________; _________和_________。
(1)0.5mol H2O的质量为g,其中含有____________________个水分子.
________________________个氢原子.
(2)质量为88克的CO2气体,其物质的量是____________ mol,在标准状况下的体积约为__________L.
(3)1.204×1024个H2O,其物质的量为___________,其中含有________ mol电子.
为探究氯水中含有的部分粒子及某些粒子的性质,某化学兴趣小组做了如下实验:
(1)观察氯水颜色,发现氯水呈黄绿色,说明氯水中肯定含有的粒子是;
(2)取少量氯水于试管中,滴入硝酸酸化的AgNO3溶液,有白色沉淀生成,说明氯水中含有的粒子是;
(3)在氯水的试管中加有色布条褪色,说明氯水中含有;
(1)由于金属钠很容易与空气中的________、________等物质反应,通常将它保存在__________里。将一小块钠用小刀切开,可以看到表面光亮,但很快变暗,该反应的化学方程式为,将一小块钠投入水中,发生反应的化学方程式为 ______________________,在反应后的溶液中加入CuSO4溶液,反应的现象是________________________,
反应的方程式为 ___________________________。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:
。
漂白粉的有效成分是(填化学式)。
5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。(本题共7分)
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的 离子方程式:
离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸 钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
| A.MnO2 | B.KMnO4溶液 | C.稀盐酸 | D.Na2SO3溶液 |
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子的物质的量是_________
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:(本题共9分)
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色; ③取溶液少许,加
③取溶液少许,加 入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:⑴在实验①中,下图所示的操作中正确的是___________(填代号)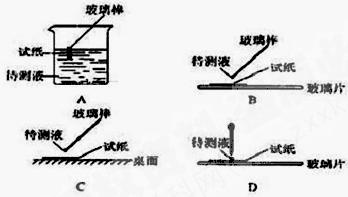
⑵根据上述实验判断原溶液中肯定存在的离子是,肯定不存在的离子是_。
⑶写出与③实验有关的离子方程式:
③_________________________________ ____________________________
____________________________