10.8 g某芳香族化合物A完全燃烧后,将生成的气体依次通过足量的浓硫酸和碱石灰,经测定前者增重7.2 g,后者增重30.8 g。A的蒸气密度是相同状况下H2的54倍。则:
(1)A的分子式为 。
(2)若A不能与NaOH溶液反应,则A的结构简式为 、 。
(3)若A与浓溴水作用时,1 mol A能消耗3 mol Br2,则A的结构简式为 。
(1)、熔点沸点HFHI;原因:
(2)、各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为
(3)、下列4种物质熔点沸点由高到低排列为________(填序号)
①金刚石(C—C)②锗(Ge—Ge)
③晶体硅(Si—Si)④金刚砂(Si—C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。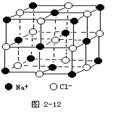
晶体中每个Na+同时吸引着______个Cl-,由这些 Cl-构成的几何构型为晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个。
(5)某元素的激发态原子的电子排布式为1s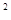 2s
2s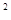 2p
2p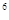 3s
3s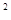 3p
3p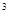 4s
4s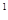 ,则该元素基态原子的电子排布式为;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为;其最高价氧化物对应的水化物的化学式是
(6)某元素原子的价电子构型为3d104S2,它属于第周期,是族,区元素,元素符号是。该原子核外有个能级,电子云的形状有种
某些共价键的键能数据如下(单位:kJ/mol)
| 共价键 |
H-H |
Cl-Cl |
Br-Br |
H-Cl |
H-I |
I-I |
N≡N |
H-O |
H-N |
| 键能 |
436 |
247 |
193 |
431 |
299 |
151 |
946 |
463 |
391 |
(1)把1molCl2分解为气态原子时,需要 (填“吸收”或“放出”) kJ能量。
(2)试通过键能数据估算H2(g)+Cl2(g)=2HCl(g)反应中的能量变化:(填“吸收”或“放出”) kJ能量。
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快,_____段收集的二氧化碳气体最多。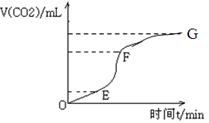
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
涉及到填写的物质写元素符号或化学式
(1)写出②号形成的单质的电子式,在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_________,
碱性最强的化合物的电子式是_____________。
(3)单质硬度最大的元素是________其氢化物结构式为_____________。
(4)最高价氧化物是两性氧化物的元素是_________;写出它的氧化物与氢氧化钠反应离子方程式____________________________________。
(5)用电子式表示元素④与⑥形成的化合物:,该化合物属于(填 “共价”或“离子”)化合物。
在①Ar ②干冰③SiO2 ④NH4Cl ⑤K2S⑥金刚石六种物质,按下列要求回答(填序号)
⑴只存在共价键的是,既存在离子键,又存在共价键的是;
⑵熔化时不需破坏化学键的是,熔化时需要破坏共价键的是;
⑶写出①的电子式是,④的电子式是。