根据已有内容的规律进行增补
(1)填化学方程式:
①2Na+2H2O=2NaOH+H2↑
②2HBr+Cl2=2HCl+Br2[
③2H2S+O2=2S+2H2O
④____________________________。
(2)已知
| 化学键 |
Si-O |
Si-Cl |
H-Cl |
Si-Si |
| 键能/KJ·mol-1 |
460 |
360 |
431 |
176 |
回答下列问题:
①比较熔点SiCl4 SiO2(填“>”或“<” ),理由
②工业制纯硅反应如下:
1/2 SiCl4(g)+H2(g)="=" 1/2Si(s)+2HCl(g)△H= +118KJ·mol-1
则H-H键能为 KJ·mol-1
实验室常用高锰酸钾与浓盐酸反应制取氯气:KMnO4+HCl——KCl+MnCl2+Cl2↑+H2O,其中还原剂是_________。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是_________mol。若需2.24 L(标准状况)氯气,反应中消耗盐酸的物质的量为_________mol,转移的电子数是_________mol。
配平下面离子方程式。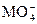 +
+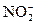 +H+——Mn2++
+H+——Mn2++ +H2O
+H2O
.配平化学方程式,并在横线上填入适当的物质的化学式。
KMnO4+KNO2+_______——MnSO4+K2SO4+KNO3+H2O
在反应4Mg+10HNO3(稀) ====4Mg(NO3)2+NH4NO3+3H2O中,氧化剂是__________,还原剂是_____________,氧化产物是_____________,还原产物是_____________。1 mol Mg转移了________________mol电子,1 mol HNO3参加反应,有__________mol HNO3被还原,得到__________mol电子。
配平下列氧化还原反应方程式
Cu2++FeS2+ ====Cu2S+
====Cu2S+ +Fe2++
+Fe2++