碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl—和SO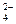 等杂质,提纯工艺路线如下:已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示。
等杂质,提纯工艺路线如下:已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示。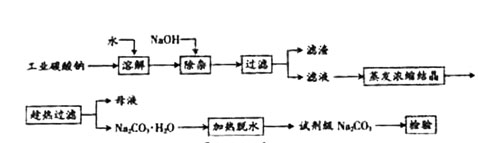
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若“母液”循环使用,可能出现的问题及其原因是 。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)  ΔH1="+532.36" kJ·mol-1
ΔH1="+532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·molˉ1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若2molCH4还原NO2至N2,整个过程中放出的热量为1734kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g) ΔH>0
2Fe(s)+3CO(g)+6H2(g) ΔH>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。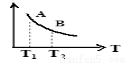
a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是:__________________________。
②当A中消耗0.05mol氧气时,B中________________极(填“a”或“b”)增重________________g。
(4)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,可向污水中加入适量的 。
a.BaSO4b.CH3CH2OHc.Na2SO4d.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
①.______________________;②. 。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是____________________。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图)。A物质的化学式是____________________。
(共11分)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 |
|||||
| (×10-3 mol·L-1) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)氨基甲酸铵(NH2COONH4)分解反应平衡常数K的表达式为_____ __。
(2)判断氨基甲酸铵分解反应的ΔH____________0(填“>”、“<”或“=”),其原因是什么?
(3)判断氨基甲酸铵分解反应的ΔS____ _0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?
(4)升高温度,化学平衡常数K如何变化? 增大容器的压强,K值如何变化? (填“变大”“变小”或“不变”)
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是()
A.2v(NH3)=v(CO2)B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应。
(1)当反应达到平衡时,N2和H2的浓度比是 ,N2和H2的转化率比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
(5)下图表示工业500℃、60.0MPa条件下合成氨,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:___ ___。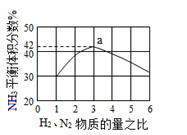
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
硫酸的摩尔质量为_____________。49克硫酸的物质的量为_____________,配制成500mL溶液,所得溶液的物质的量浓度为_____________,该溶液中含H+的个数为_____________,取出该溶液10mL即取出了_____________个SO42-。