氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应。
(1)当反应达到平衡时,N2和H2的浓度比是 ,N2和H2的转化率比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
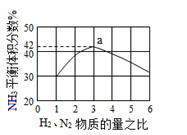
(5)下图表示工业500℃、60.0MPa条件下合成氨,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:___ ___。
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
已知:CO(g)+H2O(g) CO2(g)+H2(g) △H= -42kJ·mol-1
CO2(g)+H2(g) △H= -42kJ·mol-1
(1)在一定温度下,向一定体积的密闭容器中通入1molCO、2molH2O(g),反应达平衡时,测得放出的热量为28kJ,求CO的转化率为;
(2)该温度下,向该密闭容器中通入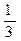 molCO2、
molCO2、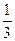 molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是;
molH2,欲使反应达平衡时CO的转化率与(1)相同,则还需满足的条件是;
(3)该温度下,向该密闭容器中通入2molCO、3molH2O(g),反应达平衡时时,求H2O(g)的转化率;
(4)该温度下,向该密闭容器中通入1.5molCO、3molH2O(g),反应达平衡时,放出的热量为kJ。
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象;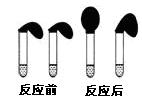
乙:① 用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/25 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH1(填“>”、“<”或“=”) ;甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4D.2 mol·L-1 HA
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有 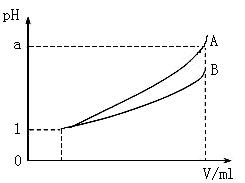
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
E.稀释后A溶液中水的电离程度比B溶液中水的电离程度小
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的NaOH溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______ _________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图示,则所用盐酸溶液的体积为___ _____ mL。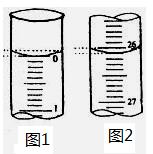
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________。
A.酸式滴定管未用标准液润洗就直接注入标准盐酸溶液
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请用上述数据计算该NaOH溶液的物质的量浓度。c(NaOH)=。
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A) =0.100mol/L、c(B) =0.200mol/L及c(C) =0mol/L。反应物A的浓度随时间的变化如图所示。请回答下列问题:
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A) =0.100mol/L、c(B) =0.200mol/L及c(C) =0mol/L。反应物A的浓度随时间的变化如图所示。请回答下列问题:
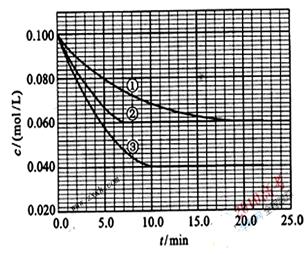
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
 ②_______________;
②_______________;
③;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的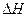 _________0,判断其理由是______ ________;
_________0,判断其理由是______ ________;
(4)该反应进行到4.0min时的平均反应速度率(读数均保留两位有效数字):
实验②: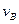 =__________________________________;
=__________________________________;
实验③: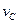 =__________________________________。
=__________________________________。
红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题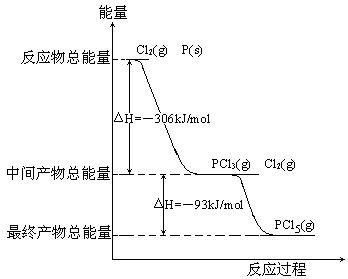
(1)P和Cl2反应生成PCl3的热化学方程式:
;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
;
温度T1时,在密闭容器中加入0.8mol PCl5 ,反应达到平衡时还剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分两步反应生成1mol PCl5的△H3=;
P和Cl 2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。
2一步反应生成1mol PCl5的△H4△H3(填“大于”,“小于”或“等于”) 。