现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
有三个电子层,且K、M层电子数之和等于L层电子数 |
| B |
最外层电子数是次外层电的2倍 |
| C |
常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| D |
元素最高正价是+7价 |
(1)写出A元素在周期表中的位置 ,B元素的名称 。
(2)写出C元素的单质的电子式 。
(3)元素D与元素A相比,非金属性较强的是 (用元素符号表示),下列表述中 能证明这一事实的是 (填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
(4)探寻物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的最高价氧化物 的水化物中化学性质明显不同于其他三种的是 (写化学式)。
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z为d区原子,且外围电子中有四对成对电子。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式、基态Z原子的核外电子排布式。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有。
(3)化合物甲由T、X两元素组成,其晶胞如图1,甲的化学式为。
(4)化合物乙的晶胞如图2,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为,其硬度超过金刚石的原因是。
②乙的晶体中E、Q两种元素原子的杂化方式分别为。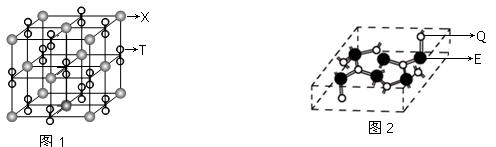
有机物A只含碳、氢、氧三种元素,分子中碳、氢、氧原子个数比为7:10:3,A具有酸性;1molA需要1mol氢氧化钠完全中和;1molA可以和1molBr2加成,已测定A的相对分子质量不大于150。各有机物的转化关系如图所示。
回答下列问题:
(1)写出A的结构简式。
(2)反应③的反应类型是。
(3)A—F六种物质中含有手性碳原子的是(用字母填写)。
(4)写出一种符合下列条件的D的同分异构体的结构简式。
①能发生银镜反应 ②能发生水解反应 ③结构中无和 环状结构
环状结构
(5)写出一定条件下F生成高分子化合物的反应方程式。
(6)丙酮酸 是E的最简单的同系物。
是E的最简单的同系物。
试以丙酮酸为原料合成乙二酸(用合成路线流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO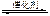 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表: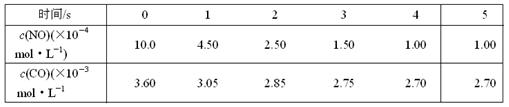

 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响): (1)在上述条件下反应能够自发进行,则反应的△H0(填写“>”、“<”、“ = ”。
(1)在上述条件下反应能够自发进行,则反应的△H0(填写“>”、“<”、“ = ”。 (2)前2s内的平均反应速率v (N2) = ___________________。
(2)前2s内的平均反应速率v (N2) = ___________________。 (3)在该温度下,反应的平衡常数K =。
(3)在该温度下,反应的平衡常数K =。 (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是。
| A.选用更有效的催化剂 | B.升高反应体系的温度 |
| C.降低反应体系的温度 | D.缩小容器的体积 |
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。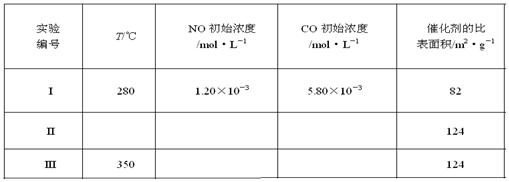
①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,请将各粒子分别填入以下空格内。
、N2,请将各粒子分别填入以下空格内。 NO3—+ + ++
NO3—+ + ++
该反应过程中,被氧化与被还原的元素的物质的量之比为。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。正极材料采用了铂网,利用铂网为正极的优点是。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如右图,则合金的质量为克。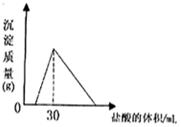
KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2,另含Al2O3、SiO2杂质)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿会导致KOH消耗量偏高,用离子方程式表示KOH消耗偏高的原因、
。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极:;阳极:。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式:
K2MnO4+CO2=KMnO4+MnO2+K2CO3
与传统法相比,液相法的优点是:___________。