(共11分)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 |
|
|
|
|
|
| (×10-3 mol·L-1) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)氨基甲酸铵(NH2COONH4)分解反应平衡常数K的表达式为_____ __。
(2)判断氨基甲酸铵分解反应的ΔH____________0(填“>”、“<”或“=”),其原因是什么?
(3)判断氨基甲酸铵分解反应的ΔS____ _0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?
(4)升高温度,化学平衡常数K如何变化? 增大容器的压强,K值如何变化? (填“变大”“变小”或“不变”)
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是( )
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:____________________________________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值_____(填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________________。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是______________________________。
(4)将c(H+)相同的这三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
(5)在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如下图所示。请回答下列问题: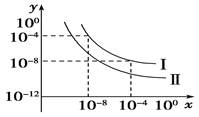
①曲线Ⅰ代表的温度下,水的离子积为_____,曲线Ⅰ所代表的温度_____(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是_________________________。
②曲线Ⅰ所代表的温度下,0.01 mol/L的NaOH溶液的pH为________。
一些酸在反应中可以表现出多种性质,如在反应Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 中:
(1)氧化剂是 ,氧化产物是 ,还原剂是 ,还原产物是 。
(2)在此反应中,浓硝酸表现出 性和 性。
(3)当生成标况下11.2 L NO2时,反应中转移的电子数是_______mol.
浅黄色粉末A跟无色液体B反应有无色气体C产生,金属D在C中燃烧可生成A,D跟B反应放出气体E,E和C又化合为B。从以上实验现象可判断(用化学式填空):
(1)A ,B ,C ,D ,E ;
(2)A与B反应的化学方程式为 ,此反应中 是氧化剂, 是还原剂;
(3)金属D在C中燃烧的化学方程式为 ,D与B反应的离子方程式为 。
(1)鉴别NaCl溶液和Na2CO3溶液的试剂是_________,离子方程式为____________________。
(2)除去混在NaCl溶液中少量NaHCO3杂质的试剂是________,离子方程式为 ______。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用________方法,化学方程式为______________________。