在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g)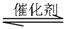 CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下 表:
表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。该反应为 反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是 。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)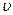 逆(H2)=
逆(H2)=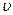 正(H2O) (d)c(CO2)=c(CO)
正(H2O) (d)c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡 移(选填“向正反应方向”、“向逆反应方向”、“不”)
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO的转化率为 。
用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯结构简式为______________________。
(2) 名称为___________________________。
名称为___________________________。
(3) 名称为___________________________________。
名称为___________________________________。
(4)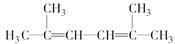 名称为___________________________。
名称为___________________________。
在①CH2==CH2,② ,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中:
,③CH3CH2OH,④CH3COOH,⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是___________;
(2)属于高分子化合物的是___________;
(3)能与Na2CO3溶液反应的是___________;
(4)能发生酯化反应的是___________;
(5)既能发生取代反应又能发生加成反应的是________________。
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X__________________,Y________________。
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________;生产过程中调节溶液的pH不能过大的原因是________________。
(3)写出产生CuCl的化学方程式:______________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_____________。
N2H4(联氨又称肼)一种无色发烟的、具有腐蚀性和强还原性的无色油状液体,它是一种重要的化工试剂,在生产和生活中有着重要的作用。
(1)推测有关N2H4的性质,下列说法正确的是
| A.具有高度吸湿性、可燃性 |
| B.有微弱的氨味,与甲醇,乙醇互溶,但不溶于乙醚、氯仿和苯 |
| C.N2H4的水溶液呈弱碱性, |
| D.联氨的水溶液既有氧化性又有还原性,酸性溶液以氧化性为主,还原产物是N2,碱性溶液以还原性为主,氧化产物是NH4+ |
E.高温加热时分解为氮气、氢气和氨气。
(2)请写出N2H5+的电子式:__________________________
(3)在高锰酸钾催化剂存在下,尿素(CO(NH2)2)和次氯酸钠-氢氧化钠溶液反应制得联氨,它和水能按任意比例互相混溶,形成稳定的水合肼N2H4·H2O写出反应的离子方程式:______________________
(4)发射卫星可用肼为燃料,用NO2作氧化剂,二者发生反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)=2NO2 (g) H=+67.7kJ•mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ•mol-1,
写出气态肼和NO2反应的热化学方程式__________。
(5)肼--空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,负极电极反应式是____________________________
大气污染物根据组成成分,可分为_________、_________( )、_________( )、_________、_________,以及_________(常用作_________,商品名为_________)等。