不同金属离子在溶液中完全沉淀时,溶液的pH不同。
| 溶液中被沉淀的离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH |
≥3.7 |
≥6.4 |
≥4.4 |
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。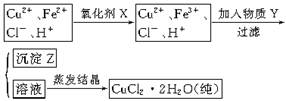
⑴下列氧化剂中最适合作氧化剂X的是 (填序号);
A.NaClO B.H2O2 C.KMnO4 D.HNO3
⑵物质Y的化学式是 ;
⑶写出沉淀Z在水中的沉淀溶解平衡方程式: 。
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: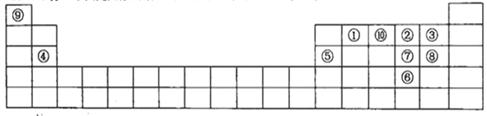
(1)在这10种元素中,非金属性最强的是(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为,元素②与⑨形成的18e-化合物的电子式;
(3)②⑨⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:>(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式。
(6)元素④和③形成的化合物属于化合物,用电子式表示其形成过程。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为,中心原子杂化类型为。
(5)①HClO4、②HIO4、③H5IO6〔可写成(HO)5IO〕的酸性由强到弱的顺序为(填序号)。
(6)IBr和水能发生反应,生成物中有一种为三原子分子,写出该化合物的结构式。
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。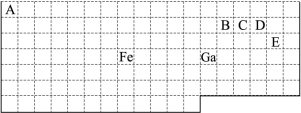
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为。
(2)Fe元素位于周期表的区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为和(填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有。
(4)根据VSEPR理论预测ED4-离子的空间构型为。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为(写2种)。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式:。若要确认其中有Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:。然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。
有一无色透明的溶液,要确定是否含有以下离子:H+、K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 |
实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊溶液 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是,溶液中肯定不存在的离子是。
(2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称(如为溶液反应,说明使用试剂的名称,不必写详细操作步骤)。。