[化学——化学与生活]
下列内容都与人们的生活和健康密切相关,请根据要求填空:
(1)学生要注意合理膳食,注意食品的多样化,防止某种营养成分过多或过少。请回答下列问题:
①大米的主要成分在人体内最终变成了 (填名称)而被人体吸收。
②坏血病是由于缺乏维生素C而引起的,下列有关维生素C的说法正确的是 。
A.维生素C是脂溶性维生素,易在体内积存
B.维生素C可作食品添加剂
C.维生素C虽然被称为抗坏血酸,但它的水溶液并不呈酸性
D.维生素C在水溶液中或受热时很容易被氧化,所以生吃新鲜蔬菜要比熟吃时维生素C的损失少
③蔬菜、水果中维生素C的含量较高,缺乏维生素C的同学在膳食中应该增加蔬菜、水果的摄入量,许多蔬菜、水果(如柠檬酸等)是 (填“酸性食物”或“碱性食物”)。
(2)下表是我国部分城市空气质量周报,阅读并回答下列问题:
| 城市 |
污染 指数 |
首要 污染物 |
空气质量级别 |
城市 |
污染 指数 |
首要 污染物 |
空气质量级别 |
| 北京 |
92 |
TSP |
II |
济南 |
76 |
TSP |
II |
| 天津 |
82 |
TSP |
II |
武汉 |
83 |
NOx |
II |
| 哈尔滨 |
96 |
TSP |
II |
重庆 |
98 |
SOx |
II |
| 上海 |
74 |
NOx |
II |
长沙 |
61 |
TSP |
II |
| 注:TSP——空气中的飘尘 |
①最容易出现酸雨的城市是______;为减少城市酸雨的产生,可采取以下措施中的 。
A.禁止用煤作燃料
B.改善燃煤质量,限制高硫煤炭的开采
C.向已酸化的土壤中加石灰
D.调整和优化能源结构,加快开发和利用新能源。
②汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式______________________________
______________________________。
(3)水是生命之源,动植物的生命活动与其密切相关,回答下列问题:
①工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是 。
。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加氢氧化钠中和 |
中和法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
沉淀法 |
| C |
含苯废水 |
用活性炭吸附 |
物理法 |
| D |
悬浮物 |
加明矾 |
混凝法 |
②我省湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种污染物的最高允许排放浓度如下表:
| 污染物 |
汞 |
镉 |
铅 |
| 主要存在形式 |
Hg2+ |
Cd2+ |
Pb2+ |
| 最高允许排放浓度/(mg·dm-3) |
0.05 |
0.1 |
1.0 |
现有某工厂每日排放的污水中汞的质量分数为(1×10-6)%,镉的质量分数为(2×10-5)%,铅的质量分数为(5×10-5)%(设该污水的密度为1 g/cm3)。根据计算该厂三项污染物中 超标。
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示。回答下列问题:
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| PH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀 |
3.2 |
9.0 |
6.7 |
(1)孔雀石研磨的目的是。
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为。
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用(填选项序号)。
A.酸性KMnO4溶液B.双氧水C.浓硝酸D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为。
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是(填代号及对应物质的化学式)。
(6)由溶液C获得CuCl2·3H2O,需要经过、、过滤等操作。
(7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+反应平衡常数。
Cu(OH)2+2H+反应平衡常数。
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题: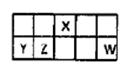
(1)写出X的原子结构示意图。
(2)列举一个事实说明W非金属性强于Z。
(3)含Y的某种盐常用作净水剂,其净水原理是(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10。处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)c(HCN)(填“>”、“<”或“=”)。
(5)已知:
①C(s)+O2(g)===CO2(g);△H ="a" kJ·mol-1;
②CO2(g) +C(s)===2CO(g);△H ="b" kJ·mol-1;
③Si(s)+ O2(g)===SiO2(s);△H ="c" kJ·mol-1。
工业上生产粗硅的热化学方程式为。
(6)已知:CO(g)+H2O(g)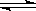 H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。
H2(g)+CO2(g)。下表为该反应在不同温度时的平衡常数。
该反应的△H0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为。
(7)一种新型氢氧燃料电池工作原理如下图所示。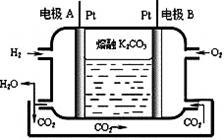
写出电极A的电极反应式。
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。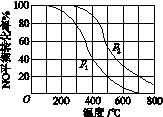
①比较p1、p2的大小关系:。
②随温度升高,该反应平衡常数变化的趋势是。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是(选填字母)。
②N2O4与O2、H2O化合的化学方程式是。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
为使电解产物全部转化为NH4NO3,需补充A。A是,说明理由:。
A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为____________;常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________;
(3)写出0.1 mol/L的A2溶液中离子浓度大小排序______________________________。
(1)已知N≡N、N—H、H—H的键能分别为946kJ·mol-1、390.8kJ·mol-1、436.0kJ·mol-1。试根据盖斯定律,写出合成氨反应的热化学方程式。
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式____________。
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做极,电极反应式为;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________,该电池总反应的离子方程式为_____________。