有原子序数依次增大的五种主族元素X、Y、Z、W、R,已知:①X与Z,Y、R与W分别同族;②X、Z、W分别与Y都可组成两种中学常见的化合物;③Y的阴离子与Z的阳离子的核外电子排布相同。根据以上叙述回答问题:
(1)R单质可用作半导体材料,写出该元素名称 它与Y元素原子序数差为_____
(2)用电子式表示化合物X2W的形成过程__________________________________。
(3)写出2种均由X、Y、Z、W 4种元素所组成的化合物在水溶液中发生反应的化学方程式_________________。Z、X、W三种元素组成的盐溶于水呈碱性,溶液中离子浓度大小顺序为:______________________________。
(4)X、Y两元素的单质已被应用于宇宙飞船的燃料电池,其结构如图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。b电极上的电极反应式为_______。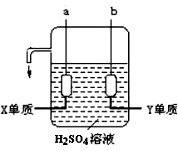
(5)请写出Z元素单质的一种用途_______。
下列各组物质① O2和O3② H2、D2、T2③12C和14C④ CH3CH2CH2CH3和(CH3)2CHCH3⑤乙烷和丁烷⑥ CH3CH2CH2CH(C2H5)CH3和 CH3CH2CH2CH(CH3)C2H5
根据题意填空(只填序号),
(1)同系物的是_;(2)同分异构体的是___。(3)同位素的是__;(4)同素异形体的是___。
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。
试判断:(1)固体混合物中肯定有,肯定没有,可能有。
(2)写出实验③离子方程式式:
(3)对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象)
写出下列反应的离子方程式
(1)过氧化钠与水
(2)金属铝与稀硫酸溶液
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A)
(B)
(5)把铜片放入稀硝酸中: ;
(1)下列物质:①H2O②石墨③Na2SO4④硫酸⑤CH3COOH⑥蔗糖,属于强电解质的是;属于弱电解质的是;属于非电解质的是(用编号填写)。
(2)在下列的空白处填写最适宜的除杂试剂或方法
①小苏打溶液中含少量苏打_______
②苏打固体中含少量小苏打_________
③CO2气体中混有少量的HCl气体________
等质量的CO和CO2,物质的量之比为;氧原子个数之比为;同温同压下,CO和CO2的密度之比为,体积之比为