A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是
① A、B、E不可能在同一主族
② A、B、C可能在同一周期
③ C的最高价氧化物的水化物可能显碱性
④ C和D的单质可能生成离子化合物。
(2)若A与D同主族,B是形成化合物种类最多的元素,C原子的最外层电子数比A与B的最外层电子总数还多1。则A与C元素按原子个数比1:1形成的化合物F的电子式为 ;C与D形成的原子个数比为1:1的化合物19.5g与足量的水反应时,反应中所转移的电子的物质的量为 mol。
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。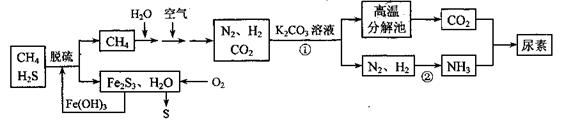
请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4___m3 (标准状况)。
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________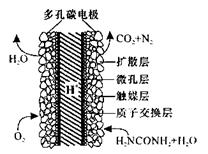
在某锂离子电池中,有一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如右: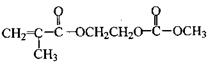
用相对分子质量为56的单烯烃A合成M的方法可设计如下: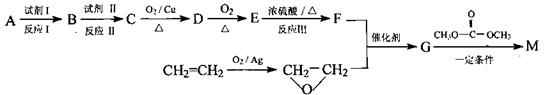
请回答下列问题:
(1)A的结构简式是_______试剂II是________,反应III的化学反应类型是_______。
(2)G在一定条件下反应生成的高聚物是制备隐形眼镜的材料,请写出生成该高聚物的化学反应方程式______________
(3)M与足量氯氧化钠溶液反应的化学方程式是______________
(4)在用E制备F的过程中,2分子的E反应会生成一种副产物,其核磁共振氢谱只有一种吸收峰,该副产物的结构简式为______________。
A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体。
(1)M的基态原子价层电子排布式为_____,元素B、D、G的第一电离能由大到时小的顺序是_____ (用元素符号表示)。
(2)用价层电子对互斥理论预测,GD32-的立体构型是_____ (用文字表述)
(3)M与D形成的一种橙红色晶体晶胞结构如图所示,其化学式为_____ (用元素符号表示)。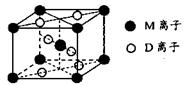
(4)已知化合物EB结构与单晶硅相似,该物质可由E 的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_____,若有8.4gB2生成,则转移电子数为_____。
2012年冬季,我国城市空气污染状况受到人们的强烈关注,其中NOx、CO、SO2是主要污染性气体。
I.汽车内燃机工作时发生的反应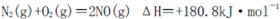 是导致汽车尾气中含有NO的重要原因之一。
是导致汽车尾气中含有NO的重要原因之一。
(1)有人欲选用合适的催化剂,使反应2NO(g)=N2(g)+O2(g)能较快进行以达到除去NO的目的。你认为该反应能否自发进行(填“能”或“不能”)。
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为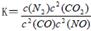 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表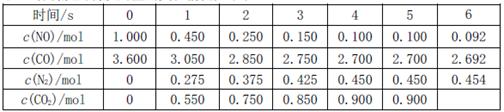
①根据土表数据计算0~4s间用NO表示的平均速率v(NO)=;达到化学平衡时两种反应物的转化率是否相等(填“相等”或“不相等”)。
②在5~6s时,若K增大,5s后正反应速率(填“增大”或“减小”)
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是。
A.选用更有效的催化剂 B.缩小容器的体积
C.降低CO2浓度D.升高温度
II为探究硫在氧气中燃烧的产物里是否有SO3,某化学兴趣小组在绝热环境下进行了定量实验探究。探究实验的相关数据如下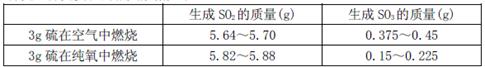
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3(填“多”或“少”),原因可能是。
A.纯氧中氧气浓度高,有利于化学平衡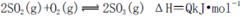 向右移动
向右移动
B.化学反应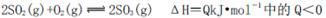
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡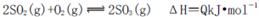 向右移动
向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡 向右移动
向右移动
已知: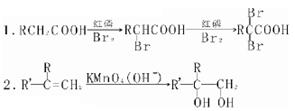
有机化合物A-I有如下转化关系:
其中通过三种现代仪器分析法得知有机物A的相关信息如下
(l)写出下列有机化学反应类型:反应①____;反应③。
(2)由H通过缩聚反应生成的链状高分子化合物的结构简式为;
I是高分子化合物,其链节为。
(3)写出反应②的化学方程式。
(4)写出满足下列条件的有机物结构简式____。
①该有机物与A具有相同的相对分子质量
②该有机物的核磁共振氢谱有三个峰且峰面积之比为1:1:6
③该有机物能发生银镜反应
④1mol该有机物与Na反应生成0 5mol氢气
(5)当1molF分别在一定条件下与足量的Na2CO3、NaHCO3和金属Na反应时,产生的气体的物质的量分别是mol、____mol、____mol。