(1)某温度(t℃)时,水的Kw=10-13 mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。
(2)将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=2,则a∶b= ;
有机物A的结构简式为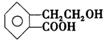 ,它可通过不同化学反应分别制得B、C、D和E四种物质
,它可通过不同化学反应分别制得B、C、D和E四种物质
请回答下列问题:
(1)指出反应的类型:A→C:
(2)在A→E五种物质中,互为同分异构体的是(填代号)。
(3)写出由A生成B的化学方程式。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出D与NaOH溶液共热反应的化学方程式。
(10分)现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小。B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物对应水化物X与其氢化物Y反应生成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题
(1)写出D、E两元素形成的原子个数比为1︰2的化合物的电子式______________
(2)写出Y与氯化铁溶液反应的离子方程式___________________
(3)某盐由A、B、D、E四种元素组成,其化学式量为82。该盐化学式_______,写出该盐与稀硫酸反应的离子方程式_____________________
(4)汽车尾气中含有B、C的氧化物,它们均为有害气体。在钯(Pd)等过渡金属的催化下,这两种气体可以相互反应转化为无害气体。请写出该转化反应的化学方程式
_____________________________________________________________________
向盛有KI溶液的试管中加入少许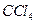 后滴加氯水,
后滴加氯水,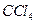 层变成紫色。如果继续向试管中滴加氯水,振荡,
层变成紫色。如果继续向试管中滴加氯水,振荡,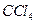 层会逐渐变浅,最后变成无色完成下列填空
层会逐渐变浅,最后变成无色完成下列填空
(1) 写出并配平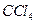 层由紫色变成无色的化学反应方程式,请在方框内填写物质,短线上填写系数。
层由紫色变成无色的化学反应方程式,请在方框内填写物质,短线上填写系数。
(2)整个过程中的具有还原性的物质有___
(3)把KI换成KBr,则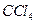 层变为__色:继续滴加氯水,
层变为__色:继续滴加氯水,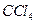 层的颜色没有变化。
层的颜色没有变化。 、
、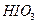 、
、 氧化性由强到弱的顺序是______
氧化性由强到弱的顺序是______
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含 的食盐)1000kg,若用KI与
的食盐)1000kg,若用KI与 反应制
反应制 ,至少需要消耗
,至少需要消耗 ________L(标准状况,保留2位小数)
________L(标准状况,保留2位小数)
已知X、Y、Z三元素的质子数都小于18且依次增大,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y形成的单质是空气的主要成分,则
(1)写出元素符号:X是、Y是、Z是
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的离子
有(写出离子符号,只要写出2种)
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式是
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图:
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_____ _ ______;Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
(3)上述装置进行2min后,再转换电键K到B,在Zn②极上发生的腐蚀属于_________,被腐蚀的金属是_____,Zn①极发生的腐蚀主要属于____________。