以A和乙醇为有机基础原料,合成香料甲的流程图如下: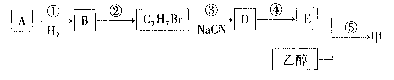
已知:R—Br+NaCN→R→CN+NaBr;
杏仁中含有A,A能发生银镜反应。质谱测定,A的相对分子质量为106。5.3g A完全
燃烧时,生成15.4g CO:和2.7g HO。
(1)A的分子式为 ,A发生银镜反应的化学方程式为 。
(2)写出反应②的化学方程式 。
(3)上述反应中属于取代反应的是: 。
(4)符合下列条件的E的同分异构体有 种;
a.能发生银镜反应 b.不含Cu c.不能水解
写出其中2种结构简式 。
(5)写出反应⑤的化学方程式 。
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水 ,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
某烃类化合物A的质谱图表明其相 对分子质量为84,红外光谱表明分子
对分子质量为84,红外光谱表明分子 中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。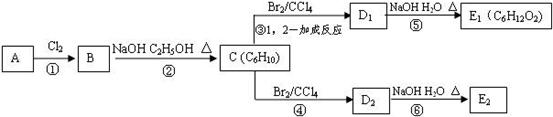
反应②的化学方程式为;C的化学名称为;E2的结构简式是;④、⑥的反应类型依次是
 。
。
汽油不仅是重要的燃料,而且是重要的化工原料,可以通过汽油裂解得到化工原料如乙烯等,还可以在催化剂作用下改变汽油分子的结构,由链烃变为芳香烃,这种变化叫做异构化。下面是以石油为原料发生的有机物的衍变关系图: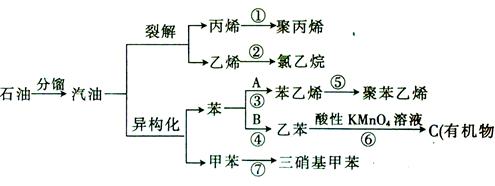
(已知:反应③,④中的原子利用率均为100%)
请回答下列问题:
(1)上述反应①~⑦中属于加成反应的有___________________(填序号,下
同),属于取代反应的有__________________。
(2)写出A,B的结构简式:A______________,B________________。
C的分子式为_________________。
(3)写出下列反应的化学方程式:
④________________________________________________________________;
⑦____________________ ____________________________________________。
____________________________________________。
某有机化合物结构如下,分析其结构并完成下列问题: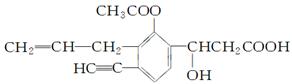
(1)写出其分子式__________。
(2)写出含氧官能团的名称________________________________。
(3)其中含有__ ___个不饱和碳原子,分子中有_______
___个不饱和碳原子,分子中有_______ _种双键,有___
_种双键,有___ _________个手性碳原子。
_________个手性碳原子。
(4)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。
按要求填空:
①写出含有乙基的C7H16的结构简式________________________________。
②写出分子式为C9H12,苯环上的一氯代物、二氯代物分别有3种,没有四氯代物的结构简式__________________________。