氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: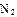 +3
+3
 2
2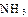 ,则在电化学合成氨的过程中,阴极反应式为_________;
,则在电化学合成氨的过程中,阴极反应式为_________;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为 ;
②右图中在状态A时,平衡常数 KA (填写代入数值
的表达式,不要求算出具体数值);当温度由T1变化到T2时,
KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
C +K2Cr2O7+H2SO4(稀)="=" CO2+K2SO4+Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是,氧化产物是。
(3)H2SO4在上述反应中表现出来的性质是。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生11.2 L(标准状况下)的气体物质,则转移的电子数目为。
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温度(℃) |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式。
②由上表数据可知该反应为放热反应,理由是。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g) CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 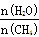 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: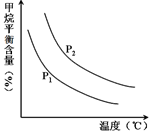
①图中,两条曲线表示压强的关系是:P1P2(填“>”、“=”或“<”)。
②该反应为反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为,该反应平衡常数的表达式为。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) =" 1" : 1 : 1 : 1
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: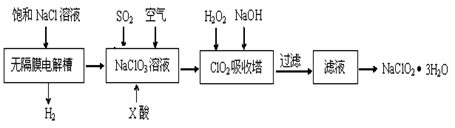
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为。
A.盐酸B.稀硫酸C.HI溶液
(3)吸收塔内的温度不能过高的原因为。
(4)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。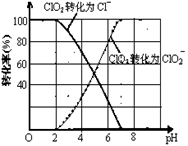
写出pH≤2时ClO2与S2-反应的离子方程式:。
有机物A、B、C、D、E、F、G、H相互转化关系如下图所示。5.2 g F能与100 mL 1 mol/L NaOH溶液恰好完全中和,0.1 mol F还能与足量NaHCO3反应,在标准状况下放出4.48 L CO2。D的分子式为C3H3O2Na,E的分子中含有羧基。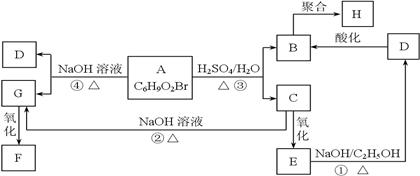
(1)写出物质C中的官能团的名称:;
(2)写出物质F、H的结构简式;
F、H;
(3)写出反应①、④的化学反应类型:①、④;
(4)写出变化①的化学方程式
(5)写出相对分子质量比B大14,且与B具有相同官能团的物质的结构简式(仅写一种)。
。
如下图是一个乙醇燃料电池工作示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: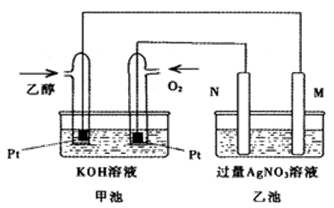
(1)M电极材料是, N的电极反应式为,加入乙醇的铂电极的电极反应式为。
(2)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出约为30kJ热量,表示乙醇燃烧热的热化学方程式为。
(3)若M、N均为石墨电极,将乙池改为电解500mL含KNO3和Cu(NO3)2的混合液一段时间后,在两极上均生成11.2L(标准状况)气体。则M极产生的气体是H2,原混合液中Cu2+的物质的量浓度是mol/L。