化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni—Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是________(填字母序号)。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ |
| C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明,一节废镍镉电池可以使1 m2面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为______________________。
(3)另一种常用的电池锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电能)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极由金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2。
试回答:锂电池比容量特别大的原因是___________________________。
锂电池中的电解质溶液需用非水溶液配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因:___________________________________________________。
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是, 电解液中H2SO4的浓度将变________,当外电路通过2mol电子时,理论上负极板的质量增加g。
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板 按下图连接,电解一段时间后,则在A电极上生成 __________,B电极上生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。
①该反应的△H0 (填“<”、“>”或“=”)。
②在温度容积不变的情况下,向该密闭容器再
增加a mol CO与 2amol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
(3)实验室中配制AgNO3溶液时通常需要向其中加入,目的是; AgCl在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是(填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是(填写序号)。
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g)△H<0。
CO2(g) +H2 (g)△H<0。
(1)CO和H2O浓度变化如上图,则在该温度下,该反应的平衡常数K=。
0~4min的平均反应速率v(CO)=_____mol·L-1·min-1。若降低温度,该反应的K值将,该反应的化学反应速率将(填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,
容器内各物质的浓度变化如下表。
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是。
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为: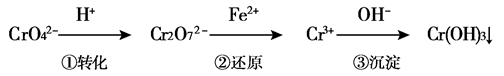
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显色。
(2)能说明第①步反应达平衡状态的是。
a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为,该还原剂反应后生成。
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)属于弱电解质的是,溶液呈碱性的有(填序号)。
(2)常温下0.01 mol/L HCl溶液的PH=;PH=11的CH3COONa溶液中由水电离产生的c(OH-) =。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因,其溶液中离子浓度按由大到小的顺序为。
(4)将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”)。
(5)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”)。
② K点对应的溶液中,
c(M+)+c(MOH)=mol·L-1。