工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为: 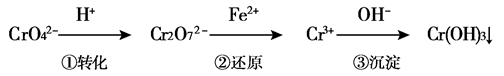
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为 ,该还原剂反应后生成 。
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。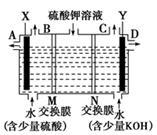
(1)X极与电源_________(填“正”或“负”)极相连,氢气从_________(填 “B” 或“C” )口导出。
(2)离子交换膜只允许一类离子通过,则M为__________交换膜(填“阴离子”或“阳离子”,下同),N为_________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为_____________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是_________,转移的电子数为________________。
3.01×1023个氨分子(NH3)含__________mol氨分子,____________mol氢原子,__________mol质子_____________个电子。
今有七种物质: ①铝线 ②熔化的KNO3 ③NH3④NaCl晶体⑤液态氯化氢 ⑥石灰水 ⑦乙醇 ⑧二氧化碳,其中属于电解质的是 ,属于非电解质的是 ,上述状态下能导电的是
用反应的化学方程式表示下列几种常见离子的检验方法。
(1)NH4Cl中的NH4+检验 ;
(2)NaCl中的 Clˉ检验 ;
(3)K2SO4中的SO42ˉ检验 。
将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 3A(g)+B(g) xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。
xC(g)+2D(g),经过4min时,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1,A在4 min末的浓度是___________,B的平均反应速率是______ __,x的值是 。