不同金属离子在溶液中完全沉淀时,溶液的pH不同。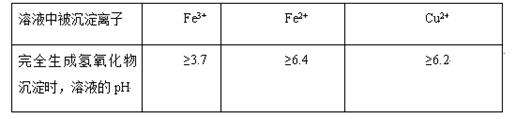
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。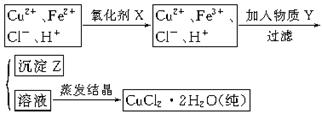
(1)下列氧化剂中适合作氧化剂X的是 (填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.Cl2 |
(2)物质Y的化学式是 、 ;(任写两种)
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式: 。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体? (填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作? 。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)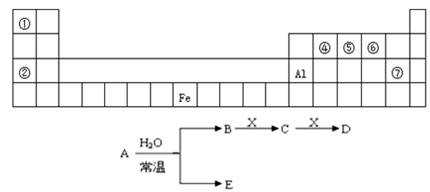
(1)若E为氧化物,则A与水反应的化学方程式为 ,该反应中氧化剂和还原剂的物质的量之比为 。
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为 .
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为 .
(2)若E为单质气体,D为白色沉淀,B含有的化学键类型为 ,其电子式是________;C与X反应的离子方程式为 .
(3)若E为含氧酸,X是②与Al元素形成的盐,D是有净水作用的白色难溶性物质,则A与水反应的离子方程式为_____________________。
(4)若A是淡黄色固体,E为碱,B是气态氢化物,C、D都是气态氧化物且会造成光化学烟雾污染,B能够使湿润的红色石蕊试纸变为蓝色,X是单质,则A与水反应的方程式是:________________,B C的化学方程式为 .
C的化学方程式为 .
“520胶”是一种快干胶,其成分为α-氰基丙烯酸乙酯(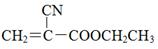 ),某校化学兴趣小组通过以下路线合成该化合物:
),某校化学兴趣小组通过以下路线合成该化合物: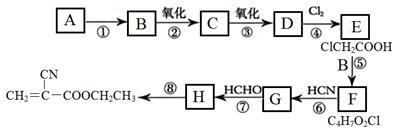
已知:①已知烃A在标准状况下的密度是1.25g/L;
② 在一定条件下甲醛可发生如下的反应:
在一定条件下甲醛可发生如下的反应: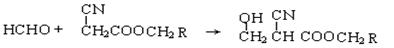
(1)A分子内σ键与π键个数之比为________;H的结构简式是: 。
(2)F中含有的官能团名称为: 。
(3)①~⑧的反应中中属于加成反应的是__________,属于消去反应的是_______。
(4)写出下列反应的化学方程式:反应②: ;反应⑥: 。
(5)α-氰基丙烯酸乙酯的同分异构体中属于芳香族化合物且与氢氧化钠溶液按1:2反应的有____种,其中核磁共振氢谱中有4组峰,且面积比为2:2:2:1的结构简式是________。
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。湿法、干法制备高铁酸盐的原理如下所示。
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
工业上用湿法制备高铁酸钾的基本流程如下图所示: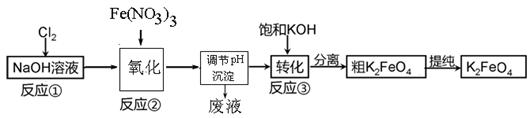
(1)高铁酸钾在处理水的过程中所起的作用有 。
(2)“氧化”过程中发生反应的离子反应方程式为 。
(3)沉淀过程中加入浓KOH溶液的作用是: 。
(4)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。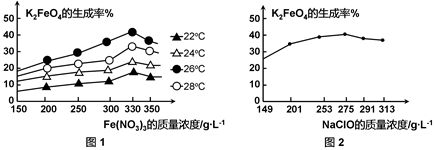
工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
(5)K2FeO4在水溶液中易“水解”:4FeO42- + 10H2O 4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3 + 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
a.H2O b.KOH、异丙醇 c.NH4Cl、异丙醇 d.Fe(NO3)3、异丙醇
(6)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O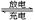 3Zn(OH)2+Fe(OH)3+4KOH,下列叙述正确的是
3Zn(OH)2+Fe(OH)3+4KOH,下列叙述正确的是
| A.放电时FeO42-向正极移动 |
| B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.充电时溶液的碱性减弱 |
现有A、B、C、D、E五种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 |
性质 |
| A |
A含有3个能级,且每个能级所含的电子数相同 |
| C |
C原子L电子层上有2对成对电子 |
| D |
D元素是第四周期元素中未成对电子数最多的元素 |
| E |
E+原子核外有3层电子且各层均处于全满状态 |
根据以上信息,回答下列问题:
(1)E元素基态原子的核外电子排布式为_________________。A、B、C三种元素的电负性由小到大的顺序为_______________(填元素符号)。
(2)BC3—的立体构型是_______________________。A与氢元素形成的一种化合物化学式为A2H4,则A2H4分子中A原子的杂化轨道类型为__________。
(3)DCl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl,则配合物化学式为 。
(4)已知C、E的一种化合物的晶胞如图所示,则该化合物的化学式为__________。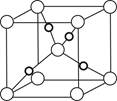
 、
、 、
、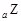 、
、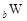 、
、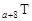 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。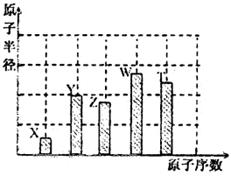
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。