电解饱和食盐水装置的结构如图所示: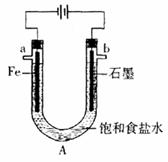
(1)写出电解食盐水的化学方程式
(2)滴入酚酞显红色的是 极(填a或b,下同),___极产生的气体可使湿润的淀粉碘化钾试纸变蓝。
(3)工业上可以用生产的氯气制备漂白粉,该反应的化学方程式
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。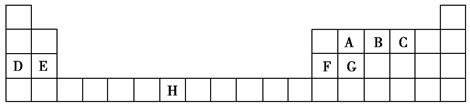
试回答下列问题:
(1)B、D、F、G的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)请写出元素H的基态原子电子排布式_____________________。
(3)A的最简单氢化物分子里中心原子采取________形式杂化,A的最高价氧化物分子的空间构型是________。
(4)D的氯化物的熔点比G的氯化物的熔点________(填“高”或“低”),理由是__________________________。
(5)元素C与元素G形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。晶胞中F原子的配位数为________,一个晶胞中F原子的数目为________。
镍(Ni)可形成多种配合物,且各种配合物均有广泛的用途。
(1)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;写出两种与配体CO互为等电子体的粒子的化学式________、________。
(2)某镍配合物结构如下图所示,分子内含有的作用力有________(填序号)。
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应,如
① ②
② 、③
、③ 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________。
(4)据报道,含有镁、镍和碳三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为________。晶体中每个镁原子周围距离最近的镍原子有________个。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答:
(1)C、Si、N元素的电负性由大到小的顺序是,C60和金刚石都是碳的同素异形体,金刚石熔点高于C60的熔点,原因是;
(2) A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式;
| 电离能/kJ•mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+颜色(填“无”或“有”);
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
① COCl2分子的结构式为 ,COCl2分子内含有(填标号);
,COCl2分子内含有(填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
② Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是。
W、X、Y、Z是短周期元素,它们的核电荷数依次增大。下表列出它们的性质和结构:
| 元素编号 |
元素性质或原子结构 |
| W |
原子电子层数与核外电子数相等 |
| X |
核外S能级上的电子总数与P能级上的电子总数相等 |
| Y |
元素的原子半径在该周期中最大(除稀有气体外) |
| Z |
原子核外P能级上的电子总数比S能级上的电子总数多2 |
⑴元素符号:X_________ , Z________。
⑵Y元素原子的核外最外层电子排布式为____________。
⑶W和X形成的化合物的电子式________________,该化合物为________分子(填“极性”或“非极性”)。Z和X形成的化合物构成的晶体属于__________晶体。
⑷Y元素的单质在W和X形成的化合物中反应的化学方程式为______________________________。
I冶炼金属常用以下几种方法:①以C、CO或H2做还原剂 ②以活泼金属Na、Mg等还原 ③利用铝热反应原理还原 ④电解法 ⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白)。
(1)Fe、Zn、Cu等中等活泼金属。
(2)Na、Mg、Al等活泼或较活泼金属。
(3)Hg、Ag等不活泼金属。
(4)V、Cr、Mn、W等高熔点金属。
II(共6分).从A.乙烯 B.乙酸 C.葡萄糖 D.纤维素 E.油脂 F.蛋白质六种有机物中选择合适的物质,将其字母序号填在空格内。
(1)属于烃类的是。
(2)能与乙醇发生酯化反应的是。
(3)植物通过光合作用直接生成的有机物是。
(4)肉、蛋、奶等富含。
(5)能作为制造肥皂的原料是。
(6)棉花、甘蔗渣的主要成分是。