下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。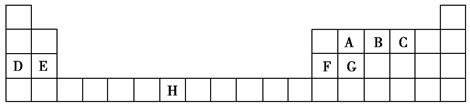
试回答下列问题:
(1)B、D、F、G的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)请写出元素H的基态原子电子排布式_____________________。
(3)A的最简单氢化物分子里中心原子采取________形式杂化,A的最高价氧化物分子的空间构型是________。
(4)D的氯化物的熔点比G的氯化物的熔点________(填“高”或“低”),理由是__________________________。
(5)元素C与元素G形成的晶体所属的晶体类型为________晶体,在该晶体中原子间形成的共价键属于________(从下列选项中选出正确类型)。
A.σ键 B.π键 C.既有σ键,又有π键
(6)F单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。晶胞中F原子的配位数为________,一个晶胞中F原子的数目为________。
选做[有机化学]]邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一
试回答:
(1)I中含氧官能团的名称和。
(2)II→III的反应类型。
(3)①IV与乙醇和浓硫酸混合加热的化学方程式。
②IV与过量NaOH溶液反应的化学方程式。
(4)有机物X与IV互为同分异构体,且X有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出X的一种结构简式。
选做[物质结构与性质](10分)
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为______<______<______ (填元素符号)。
(2)E元素基态原子的电子排布式为________________________________。
(3)XZ2的分子中含有个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是____________。
(5)将YH3通入灼热EZ中发现黑色固体变红色,生成物对大气不造成污染。请写出有关化学方程式。
(12分)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y的氢化物和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。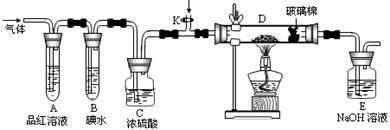
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为;若装置D中装的是五氧化二钒(作催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 |
| B.稀盐酸 |
| C.稀硝酸 |
| D.氯化钙 |
E.双氧水
F.硝酸银
(16分)短周期元素A、B、C、D、E的原子序数依次增大,已知:
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5︰1︰1︰3。
请回答下列问题:
(1)C的气态氢化物的电子式为,A在周期表中的位置。
(2)化合物E2D2中阴、阳离子个数比为,F含有的化学键类型为。
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为。
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式。
(5)C2A4空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30% KOH溶液。该燃料电池的负极反应式为________。
(6)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ·mol-1
2NO2(g)=N2O4(g)△H=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 ____________
选考[化学—选修5 有机化学技术] (15分)
2013年1月13日中国应用技术网报道了利用苯制备偶氮染料和医药中间体的方法,下面是制备偶氮染料F和医药中间体Y的流程图如下:

回答下列问题:
(1)苯的核磁共振氢谱中有________峰,反应①的反应类型____________;
(2)写出D→E反应的化学方程式______________________。
(3)写出化合物A、F的结构简式: A____________、F____________。
(4)设计A→D的目的是______________________。
(5)写出满足下列条件的C的任意两种同分异构体的结构简式________。
a.是苯的对位二取代产物; b.能发生银镜反应
(6)参照上述流程图设计从X到Y的合成路线。