在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
(1)CO和H2O浓度变化如上图,则在该温度下,该反应的平衡常数K= 。
0~4min的平均反应速率v(CO)=_____mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,
容器内各物质的浓度变化如下表。
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
反应
 (
)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
(
)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示: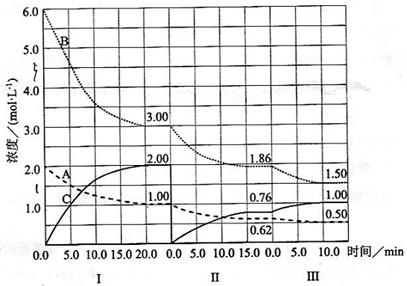
回答问题:
(1)反应的化学方程式中,
为;
(2)
的平均反应速率
、
、
从大到小排列次序为;
(3)
的平衡转化率
中最小的是,其值是;
(4)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(5)比较第II阶段反应温度(
)和第III阶段反应速度(
)的高低:
填">、=、<"判断的理由是;
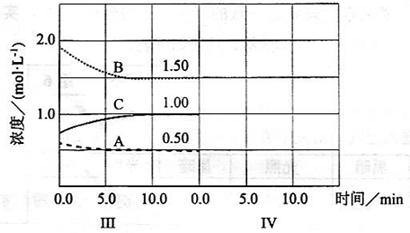
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10
后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出
、
、
).
下图中,
是单质,
是
分别和
形成的二元化合物。已知:
①反应
能放出大量的热,该反应曾应用于铁轨的焊接;
②
是一种常见的温室气体,它和
可以发生反应:
+
+
,
中
元素的质量分数为60%。

回答问题:
(1)①中反应的化学方程式为 ;
;
(2)化合物
的电子式为,它的空间结构是;
(3)1.6
溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出粒子方程式和计算过程);
(4)
与过量
溶液反应的粒子方程式为;
(5)
在
中燃烧观察到的现象是。
已知:
1.冠心平
是降血脂、降胆固醇的药物,它的一条合成路线如下

(1)
为一元羧酸,8.8
与足量
溶液反应生成2.24
(标准状况),
的分子式为。
(2)写出符合
分子式的所有甲酸酯的结构简式:
。
(3)
是氯代羧酸,其核磁共振氢谱有两个峰,写出
的反应方程式:。
(4)
的反应类型为。
(5)写出
和
的结构简式:
_;
。
(6)
的苯环上有两种氢,它所含官能团的名称为;写出
所代表的试剂:
;
。
Ⅱ.按如下路线,由
可合成高聚物
:
(7)
的反应类型为.
(8)写出
的反应方程式:_。
图中
、
、
为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,
俗称磁性氧化铁:
是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
(1)组成单质
的元素在周期表中的位置是;
中存在的化学键类型为;
的化学式是。
(2)一定条件下,
与
反应生成
,
的电子式为。
(3)已知
与1
反应转化为
时(所有物质均为固体)。放出
热量。写出该反应的热化学方程式:
。
(4)写出
和
的稀溶液反应生成G的离子方程式:
(5)问含4
的稀溶液中,逐渐加入
粉末至过量。假设生成的气体只有一种,请在坐标系中画出
随
变化的示意图,并标出
的最大值。
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法出去,产生的尾气经处理后可用于刚才镀铝。工艺流程如下: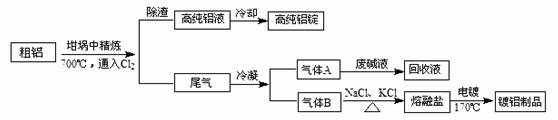
(注 :
熔点为801
;
在181
升华)
:
熔点为801
;
在181
升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①和②
(2)将 连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除 外还含有;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在
(3)在用废碱液处理 的过程中,所发生反应的例子方程式为
(4)镀铝电解池中,金属铝为极,熔融盐电镀中铝元素和氯元素主要以 和 形式存在,铝电镀的主要电极反应式为
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是