为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图:
回答下列问题:
(1)根据原电池原理填写下表:
| 装置序号 |
正极 |
负极反应式 |
阳离子移动方向 |
| 甲 |
|
|
|
| 乙 |
|
|
|
| 丙 |
|
|
|
| 丁 |
|
|
|
| 戊 |
|
|
|
(2)电极类型除与电极材料的性质有关外,还与________有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应?_____
(填“是”“否”或“不一定”),请举例说明:__________________________________________。
(4)指出下列电池的放电过程中,电解质溶液酸碱性的变化:甲_______,丙_______,戊_______。(填酸性或碱性增强或减弱)
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是,。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件, 能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅, 其反应如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合气体密度保持不变 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
(4)若平衡时H2和HCl的物质的量之比为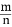 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比 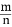 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
| A.热裂解形成燃油 | B.露天焚烧 | C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 铜平均溶解速率(×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
(5) 已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ; H
H
用△H1、△H2和△H3表示 H,
H, H= 。
H= 。
(6)已知1 g FeS2(s)完全燃烧生成放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为 。
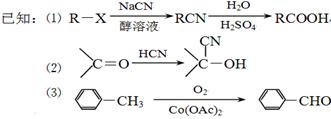
现用如下方法合成高效、低毒农药杀灭菊酯 ( ) :
) :

(1)B的结构简式是_____________;合成G的反应类型是__________。
(2)有关A的下列说法正确的是__________(填序号)。
a.A与苯互为同系物
b.A的核磁共振氢谱有5个峰
c.充分燃烧等物质的量A和环己烷消耗氧气的量相等
d.A的所有原子可能处在同一平面上
e.A不能使酸性KMnO4溶液褪色
(3)写出反应 F+I→杀灭菊酯的化学方程式:___________________。
(4)写出C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式:
______________
(5)D在硫酸存在下发生水解生成J:D 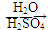 J,写出符合下列要求的J的所有同分异构体的结构简式:___________________。
J,写出符合下列要求的J的所有同分异构体的结构简式:___________________。
①苯环上有两个位于间位的取代基;②能水解成两种有机物;③可以银镜反应。
(6)X与F互为同分异构体,X苯环上有三个取代基且含有 结构,则符合此条件的X共有种。
结构,则符合此条件的X共有种。
已知A、B、C、D、M、W六种元素的原子序数依次递增,都位于前四周期。其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且S轨道电子数是P轨道电子数的两倍;C原子L层上有2对成对电子。M和W均有“生物金属”之称,M4+离子和氩原子的核外电子排布相同;W处于周期表中第8列。请回答下列问题:
(1)l mol B2A2分子中含σ键的数目是。
(2)BC 2在高温高压下所形成的晶体其晶胞(晶体中最基本的重复单元)如图所示。则该晶体的类型属于晶体(选填“分子”、“原子”、“离子”或“金属”);该晶体中B原子轨道的杂化类型为。
(3)“生物金属”M内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。若该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,M原子的摩尔质量为Mr g/mol,则该晶胞的“边长”为cm。
(4)“生物金属”W元素应用广泛,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。
①W元素基态原子价电子排布式为。
②CN—与(一种单质分子)互为等电子体。
(5)光谱证实单质D与强碱溶液反应有[D(OH)4]—生成,则[D(OH)4]—中存在。
a.极性键 b.配位键 c.σ键 d.π键