某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。请回答下列问题。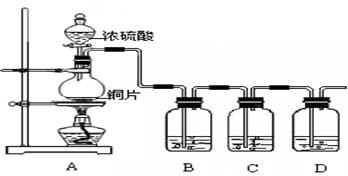
(1)铜和浓硫酸反应中浓硫酸的作用为 (A、强氧化剂 B、强还原剂)。
(2)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为 SO2具有 ,C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有 。(填选项的字母)
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,该反应的主要产物的化学式为 。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入
(填选项的字母)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3
)粗盐的提纯是生产生活中的重要工艺过程,某校研究小组查阅资料发现,粗盐中除了含有NaCl外,还含有CaCl2、MgCl2和一些硫酸盐及泥沙等杂质。他们要除去杂质得到精盐,设计了下列实验流程方案。(步骤②③④中的试剂均过量)。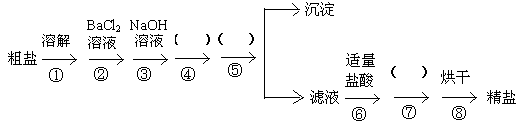
(1)操作①中玻璃棒的作用是,第④步小括号中的试剂是,第⑤步小括号中操作的名称是。第⑦步小括号中操作的名称是。
(2)第②步中加入过量BaCl2溶液的实验现象:,反应的离子方程式。(3)实验流程方案中“沉淀”的主要成分是、、、。(填化学式)
(4)第⑹步中加入适量盐酸的目的是:
。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种流程如下:
请回答下列问题:
(1)给滤液E中通入过量的NH3,其反应的离子方程式是____________________。
(2)流程Ⅱ中加入烧碱溶液后,生成SiO 的离子方程式是__________________。
的离子方程式是__________________。
(3)验证滤液A中含Fe3+,可取少量滤液并加入______________(填写试剂名称)。
(4)滤液C中溶质的主要成分是___________(填化学式)。
(5)滤液F中离子电荷守恒的关系式为___________________________。
(6)滤液C和滤液F共同的溶质为G,用惰性电极电解500mL 0.1 mol·L-1的G溶液,若阳极得56 mL气体(标准状况),则所得溶液在常温下pH为_____________(忽略电解前后溶液体积的变化)。
(7)已知25 ℃时Mg(OH)2的溶度积常数Ksp=1.8×10-11。取适量的滤液A,加入一定量的烧碱溶液至达到沉淀溶解平衡,测得该溶液的pH=13.00,则25℃时残留在溶液中的c(Mg2+)=________ mol·L-1。
分某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)写出装置A中发生反应的化学方程式:
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄
红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和
假设二:存在三种成分: NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 |
预期现象和结论 |
||
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|||
| 步骤2: |
①若无明显现象,证明固体中不含Na2CO3 ②若溶液变浑浊,证明固体中含 Na2CO3 |
||
| 步骤3: |
|
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
硫酸铜是一种用途广泛的化工原料。某学习小组把适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全.通过蒸发、结晶得到硫酸铜晶体(装置如图I、Ⅱ所示)
(1)图Ⅱ是图I的改进装置。其优点有。
(2)为符合绿色化学的要求,该学习小组进行了如下探究:将氧气直接通入到铜粉与稀硫酸的混合物中,发现常温下几乎不反应,但向混合物中加入FeSO4后再通入氧气,反应则立即发生试用离子方程式表示反应发生的原理___________________________________;在该反应中FeSO4的作用是__________________。
(3)为寻找更加适宜的氧化剂,该小组又进行了如下探究:称量3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50℃,加入18 mL 10%的H2O2,反应30 min后升温到60℃,持续反应1小时后铜丝反应完全。蒸发、冷却、结晶,过滤时用少量95%的酒精淋洗晾干,得到10 g CuSO4·5H2O。
①该实验铜丝被氧化的原理是(用离子方程式表示)_____________________________。
②反应过程中温度不宜过高的原因是________________________________________,过滤时采用酒精淋洗的优点是。
③该小组得到硫酸铜晶体的实际产率是_____________________。
某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置: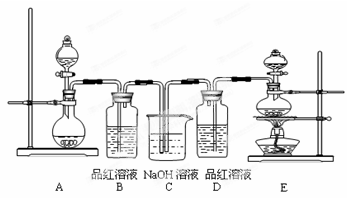
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质 、
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,分别取少量B、D两个装置中的液体于试管中加热,两个试管中的现象分别为:
B
D
(3)装置C的作用是
(4)写出等物质的量的Cl2与SO2反应的离子方程式