铝土矿的主要成分是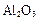 ,还含有
,还含有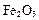 、
、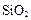 等杂质。
等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:

(1)试剂A是 ;溶液b与试剂B反应的离子方程式为 。
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)电解时,阳极的电极反应方程式为 ;每生产0.324吨铝,理论上转移电子的物质的量为 mol。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: 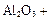
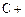
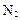

 CO(请配平)
CO(请配平)
②氯化铝与氨气高温合成法:


(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
(14分) 以甲苯为原料可以合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PAS-Na)的路线如下: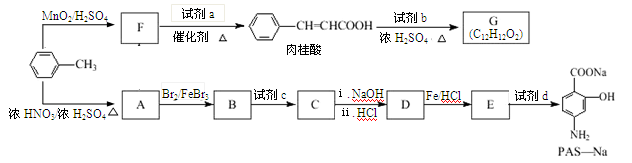
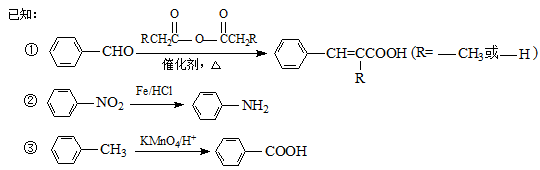
回答下列问题:
(1)由B生成C的反应类型是。
(2)肉桂酸中含氧官能团的名称是。
(3)写出由A生成B的化学方程式:。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:。
(5)当试剂d过量时,可以选用的试剂d是(填字母序号)。
a.NaOHb.Na2CO3c.NaHCO3
(6)写出C与NaOH反应的化学方程式:。
(7)在肉桂酸分子中碳碳双键催化加氢后得到化合物X(分子式为C9H10O2),X有多种同分异构体,符合下列条件的有种。
a.苯环上有两个取代基;b.能发生银镜反应;c.与Na作用有H2产生
(16分)连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验:
I.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
(2)2Na2S2O4+4HCl= 4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl= 2NaCl+S↓+SO2↑+H2O。
II.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
冷却至40~50℃,过滤,用洗涤,干燥制得Na2S2O4。
III.【Na2S2O4的性质】
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/L
Na2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,根据pH变化图,HSO3-的电离程度水解程度(填“<”或“>”)。
课题小组推测Na2S2O4溶液在空气中易被氧化,0~t1段发生离子反应方程式为。t3时溶液中主要阴离子符号是。
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容。
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) |
预期的实验现象和结论 |
(16分)已知A、B、C、D是原子序数依次增大的四种短周期元素,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、D的基态原子的第一电离能由大到小的顺序为。
(2)M分子中B原子轨道的杂化类型为。
(3)E+的核外电子排布式为,下图是由D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为。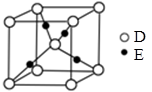
(4)化合物CA3的沸点比化合物BA4的高,其主要原因是。
(5)写出与BD2互为等电子体的C3-的结构式。
(6)微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置.最早用于有机废水处理,下图是利用微生物燃料电池处理含M废水的装置,其中3是质子交换膜.负极所在的左室中发生反应的电极反应式是。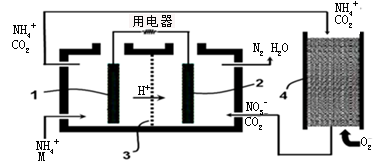
(7)铁粉和E单质粉末的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO).则稀硝酸的浓度为mol/L。
| 编号 |
① |
② |
③ |
④ |
| 稀硝酸的体积/mL |
100 |
200 |
300 |
400 |
| 剩余金属的质量/g |
18.0 |
9.6 |
0 |
0 |
| NO的体积/mL |
2240 |
4480 |
6720 |
V |
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下: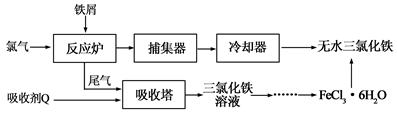
(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式:。
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:。
②样品中氯化铁的质量分数为(用字母m、C、V来表示)。
(12分,每空2分)
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:
N2(g)+3H2(g) ⇌2NH3(g);△H<0
其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
| t/K |
298 |
398 |
498 |
… |
| K/(mol·L-1)2 |
4.1×106 |
K1 |
K2 |
… |
①比较K1、K2的大小:K1K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是(填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.混合气体中氢气的质量不变
C.容器内压强保持不变
D.混合气体的密度保持不变
③某温度下,在一个10L的固定容器中充入2molN2和4molH2进行如下反应 N2(g)+3H2(g) ⇌2NH3(g);△H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=(mol/L)-2 ,平衡时NH3的体积分数为。
(2)①肼(N2H4)高效清洁的火箭燃料。8g气态肼在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为。
②盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,则盐酸肼中含有的化学键类型有。