阿魏酸在医药、保健品、化妆品原料和食品添加剂等方面有着广泛的用途,其
结构简式为
⑴阿魏酸可以发生 (填选项字母)。"
a.酯化反应 b.消去反应 c.加成反应 d.氧化反应 e.银镜反应
⑵阿魏酸的一种同分异构体A 可用于制备有机玻璃(聚甲基丙烯酸甲酯),转化关系如下图所示:
己知A 和B都能与FeCl3溶液发生显色反应,B的一溴代物只有一种,A、C能发生银镜反应。
①B的结构简式为____________,C含有的官能团为____________。
②D→E的化学方程式为____________________________________。
③A的结构简式为__________________________________________。
(3)写出所有符合下列条件的阿魏酸的同分异构体的结构简式。
①苯环上有两个取代基,且苯环上的一漠代物只有2 种;
②能发生银镜反应;
③与碳酸氢钠溶液反应可放出使澄清石灰水变浑浊的气体;
④与FeCl3溶液发生显色反应__________________________________________。
依据题意完成以下各题:
(1)实验室常用加热氯化铵和氢氧化钙的固体混合物制取氨气,该反应的化学方程式是______________________________________。
(2)工业上用氨气制取NO的化学方程式是_______ 。
(3)实验室制取SO2的化学方程式。
(4)除去Na2CO3中的NaHCO3的化学方程式。
以下几种物质:
①3.0 g H2②1.5molHCl气体③2mol氩气, 请回答:
(1)含有分子数最多的是___________ _ (填序号,下同);
(2)标准状况下体积最大是。
(3)同温同压下密度最小的是。
【化学—有机化学基础】瘦肉精又名克伦特罗(4-氨基-α-叔丁胺甲基-3,5-二氯苯甲醇),是一种β2肾上腺素受体激动剂,临床上用于治疗哮喘。可由下图所示路线合成: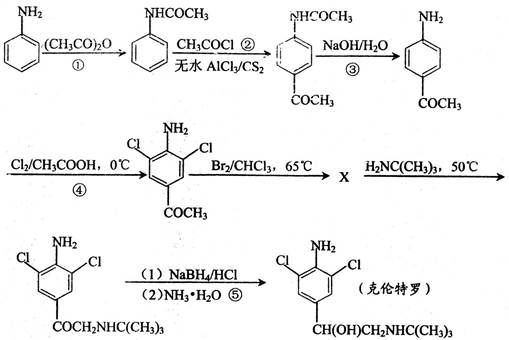
其中X表示某中间物质,请回答下列问题。
(1)判断反应④的反应类型。
(2)书写反应③所代表的化学反应方程式:
。
(3)试推断中间物质X的结构简式:。
(4)对氨基苯乙酮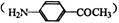 的同分异构体有多种,请写出符合以下条件的其中任意一种
的同分异构体有多种,请写出符合以下条件的其中任意一种
a.苯环与氨基相连 b.与新制的Cu(OH)2悬浊液加热,有红色物质生成
c.苯环上有2个取代基
(5)①②③代表的整个反应过程完成了苯胺对位的酰基化,也完成了对(填官能团名称)的保护,同时也避免了一些副反应的发生。
【化学—物质结构与性质】氯是一种非常重要的非金属元素。
(1)氯元素的基态原子的价电子层排布式是。
(2)氯化氢的沸点远低于氟化氢,液态氟化氢的化学式有时写成(HF)n,其原因是:.
(3)光气(COCl2)中C原子采取杂化成键,其碳氧原子间的共价键含有(填“σ”或“π”键及个数)。
(4)元素Cu的一种氯化物的晶胞结构如图所示(黑球表示铜原子,白球表示氯原子),该氯化物的分子式,它可与浓氨水反应生成无色溶液,在空气中放置一段时间,最终溶液变成深蓝色,则深蓝色溶液中生成配合物为(填化学式)。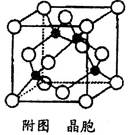
【化学—化学与技术】硫酸是一种重要的化工原料,硫酸工业的“三废”处理之一是对尾气处理,其中一种方法便是用天然海水进行尾气脱硫。
(1)硫酸工业生产的主要设备有、和吸收塔。在吸收塔内装有大量磁环的作用是,浓硫酸从塔顶喷下,SO3吸收操作采取形式(原理);硫酸工业的尾气主要成分有SO2、O2、N2等。
(2)天然海水主要含有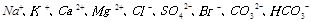 等离子。
等离子。
①天然海水pH约为8,原因是海水中离子水解所致。
②尾气进入吸收塔内,塔顶喷下大量海水,O2能将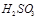 、
、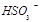 、
、 等氧化,试写出其中一个反应的方程式:。
等氧化,试写出其中一个反应的方程式:。
③向氧化后的海水中加入天然海水,其目的是中和、稀释氧化后海水中生成的酸,最终排放出的海水中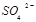 浓度与进入吸收塔的天然海水相比,
浓度与进入吸收塔的天然海水相比,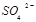 浓度(填序号)。
浓度(填序号)。
| A.减少 | B.增大 | C.不变 | D.无法判断 |