向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应: 2X(g)  Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min 后反应达到平衡 , 此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为 mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)="3.5" mol/(L·min); 乙:v(Y)="2" mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)="0.075" mol/(L·s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) ;
(3)若向达到(1)的平衡体系中充入氮气,则平衡向 (填"左"或"右"或"不)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向 (填“左”或“右”或“不”)移动;
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则平衡后X 的转化率与(1)的平衡中X的转化率相比较:
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol, 达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为 ;
(6)若保持温度和体积不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl(g) +O2(g) Cl2 (g)+2H2O (g)
Cl2 (g)+2H2O (g)
已知:i.反应A中, 4mol HC1被氧化,放出115.6kJ的热量。 ii.
ii.
H2O的电子式是_______________。
反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知 N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1,
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________。
(5)已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H =" +" 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的
热化学方程式: ________________________________。
①CaCO3=" CaO" + CO2ΔH=+177.7kJ·mol-1
②C(s) + H2O(g) =" CO(g)" + H2(g)ΔH=131.3kJ·mol-1
③1/2 H2SO4(aq) + NaOH(aq) =1/2Na2SO4(aq) + H2O(l)ΔH= —57.3kJ
④C(s) + O2(g) = CO2(g)ΔH=—393.5kJ·mol-1
⑤CO(g) + 1/2O2(g) = CO2(g)ΔH=—283kJ·mol-1
⑥HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l)ΔH=—57.3kJ·mol-1
(1)上述热化学方程式中,不正确的有;
(2)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有。
某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
2.00 |
0.00 |
| 1 |
0.90 |
1.80 |
0.20 |
| 3 |
0.75 |
1.50 |
0.50 |
| 5 |
0.65 |
1.30 |
0.70 |
| 9 |
0.55 |
1.10 |
0.90 |
| 10 |
0.55 |
1.10 |
0.90 |
| 14 |
0.55 |
1.10 |
0.90 |
(1) 体系中发生反应的化学方程式是____________;
(2) 计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3) 该反应达到平衡时反应物X的转化率α等于________;
(4) 如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1所对应的实验条件改变是:______ ______。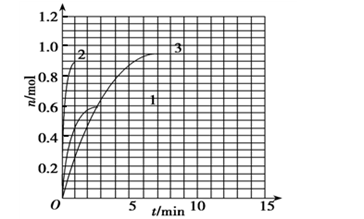
(5)如果起始加入X、Y、Z的物质的量分别为2.00 mol、4.00 mol和0 mol,在原温度下达平衡时,X的转化率为α!,则α! α(填 < > =)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00 mol、1.00 mol和1.00 mol,此时可逆反应的反应速率:u(正)u(逆)(填 < > =)。
在一密闭容器中发生反应N2+3H2 2NH3 , ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3 , ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是__________(填选项)。
A t0~t1 B t1~t2C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项),t1时刻________; t4时刻________。
A 增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。