I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH=a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度T/K |
303 |
313 |
323 |
| NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0 (填“> ”“<”或“=”)
”“<”或“=”)
②已知:
N2 (g) + 3H2(g) 2NH3 (g) ΔH=-92.4kJ·mol-1,
2NH3 (g) ΔH=-92.4kJ·mol-1,
2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6kJ·mol-1,
则2N2 (g) + 6H2O(l) 4NH3 (g) + 3O2 (g) ΔH= ;
4NH3 (g) + 3O2 (g) ΔH= ;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是 (填字母标号)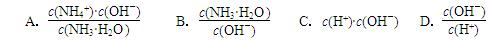
II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g) 2SO3 (g) ΔH=-196.0kJ·mol-1
2SO3 (g) ΔH=-196.0kJ·mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是 (填字母标号)
| A.加入V2O5作催化剂 | B.使用过量SO2 | C.高温 | D.通入过量空气 |
②某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是 ,该温度下的平衡常数K= ;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将 (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 。
已知HIO呈两性,其碱式电离方程式为_________________________,若它与盐酸反应,则反应的方程式为___________________________。
将铁与氧化铁的混合物15g加入150mL稀硫酸中,在标准状况下生成1.68LH2,同时固体物质全部溶解,向溶液中加入KSCN溶液,未见颜色改变。为中和过量的硫酸且使铁全部转化为Fe(OH)2,共消耗3mol/LNaOH溶液200mL,则原硫酸溶液物质的量浓度为 ( )
| A.2mol/L | B.1.8mol/L | C.4mol/L | D.2.2mol/L |
下面是有关物质的转化关系图(有些物质己省略),其中A为单质,E在常温下为液体,D是一种含氧的化合物,请回答相关问题。
(1)若C的式量为78,则对C的结构、性质推断中不正确的是_____
A.久置于空气中会变成白色
B.具有强的氧化性
C.晶体存在离子键与非极性键
D.与湿润的紫色石蕊试纸接触时,只能使试纸变蓝色
(2)A的原子结构简图______________,H的电子式___________,E的结构式_________
(3)若C也是含氧化合物且氧为18O时,写出C与D反应的方程式___________________
_______________,另一产物(D以外)的摩尔质量为______。
(4)当A量较少时,I不可能是____________
A.H2O B.NaCl(aq) C.NaOH(aq) D.CuCl2
(5)若没有E在常温下为无色液体的限制,则E、I还可分别是_________、_________(填物质名称)
同学们吃的零食的包装袋中经常有一个小纸带,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是(用化学方程式表示)______________________________。
(3)生石灰还可以跟哪些类别的物质发生化学反应?列举两例,并写出化学方程式。
(4)小纸带中的物质能否长期持续地做干燥剂?为什么?
(5)在你所认识的化学物质中,还有哪些可以用作干燥剂?举出一例。
在一定条件下,RO3 n-和 I-发生的离子方程式如下:
RO3 n-+ 6I- + 6H+ ="=" R- + 3I2 + 3H2O
(1)RO3n-中R元素的化合价是_____________
(2)R元素的原子最外层电子数是________。