下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。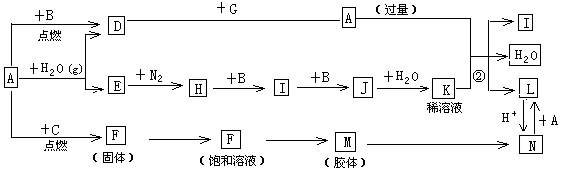
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
②请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下: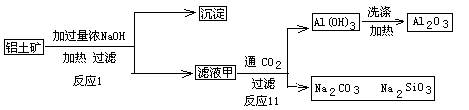
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—
已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的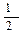 ,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):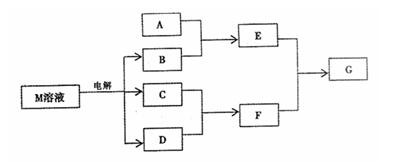
(1)若A是与X、Y同周期的一种常见金属单质,则A与B溶液反应的化学方程式是: ;
; (2)若A是一种常见酸性氧化物,且可用于制造玻璃,则E与F反应的离子方程式是:
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则E与F反应的离子方程式是: ;
; (3)若A是一个溶液,只可能含有H+、NH4+、Mg2+、Fe3+、
(3)若A是一个溶液,只可能含有H+、NH4+、Mg2+、Fe3+、 Al3+、CO32-、SO2- 中的某些离子,当向该溶液中加入
Al3+、CO32-、SO2- 中的某些离子,当向该溶液中加入 B溶液时,发现生成沉淀的物质的量随B溶液的体积
B溶液时,发现生成沉淀的物质的量随B溶液的体积 变化如图所示,由此可知该溶液中肯定含有的离子
变化如图所示,由此可知该溶液中肯定含有的离子 有。
有。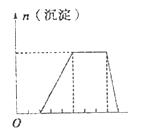
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。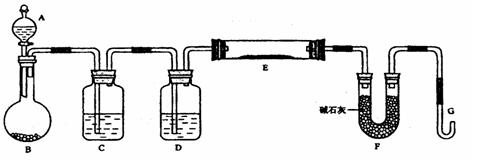
请回答下列问题:
(1)仪器中装入的试剂:C__________、D__________;
(2)连接好装置后应首先__________,其方法是:__________。
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是_________,在这两步之间还应进行的操作 ________________________;
(4)从实验中测得了下列数据
①空E管的质量a②E管和WO3的总质量b
③反应后E管和W粉的总质量c (冷却到室温称量)
④反应前F管及内盛物的总质量d⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________:计算式2:Ar(W)=___________。
甲、乙、丙是前18号元素形成的常见单质,A、B、C、D是前18号元素形成的不同化合物,甲、乙、丙和A、B、C、D有如下图所示的转化关系,丙是生命活动须臾不可缺少的气态单质,请回答下列问题:
(1)若甲为金属单质,A常温下为气体,则A的化学式为,写出反应①的化学方程式:;
标出反应②电子转移的方向和数目:
。
(2)若甲为非金属单质,A常温下为液态,则A的电子式为, C的化学式为,指出B的一种用途,写出反应②的离子方程式:。
(1)物质X是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
① 若X为氧化物,X的化学式是____________。
② 若X为单质,X用于焊接钢轨反应的化学方程式是_________________________。
③ 若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与稀硫酸反应的离子方程式是 ;
X与足量稀氢氧化钠溶液反应的离子方程式是。
(2)在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是。
科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是________。
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+ 离子半径逐渐减小;化合物XN常温下为气体,据此回答: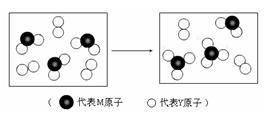
(1)写出Z与N形成化合物的电子式。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:。
(3)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:
。