稀土元素(包括钇、钪和镧系等金属元素)是能源、信息等领域的领域的关键材料,我国稀土产量占世界的85%以上。镧(La)镍(Ni)的某种合金可表示为LaNi5,它具有神奇的吸氢能力(最大储氢量达到 个氢原子/cm3),反应如下:LaNi5H6
个氢原子/cm3),反应如下:LaNi5H6 LaLi5+3H2,其中固体LaNi5H6具有导电必,被称为金属型氢化物。
LaLi5+3H2,其中固体LaNi5H6具有导电必,被称为金属型氢化物。
试回答:
(1)氢位于周期表的 族,该族元素的金属性随原子序数递增而 ;
(2)对于反应LaNi5H6 LaLi5+3H2,保持温度不变,当平衡 (填“正向移动”或“逆向移动”)时,LaNi5的吸氢量会增加。温度升高后,若平衡常数K值变大,平衡 (填“不移动”、“向正向移动”或“向逆向移动”)。LaNi5吸氢的适宜条件是 ;
LaLi5+3H2,保持温度不变,当平衡 (填“正向移动”或“逆向移动”)时,LaNi5的吸氢量会增加。温度升高后,若平衡常数K值变大,平衡 (填“不移动”、“向正向移动”或“向逆向移动”)。LaNi5吸氢的适宜条件是 ;
(3)镍可用于制镉镍电池,但镉元素对环境有污染,为此,人们开发了碱性氢镍电池,它利用LaNi5良好的吸氢能力,用固体NaLi5H6作负极反应物,其中氢元素的化合价为 ,电池放电时,发生氧化反应的电极反应式为 。电池充电时,每转移2mole-,最多形成 cm3LaNi5H6;
(4)已知液态氢的密度为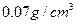 ,则相同体积LaNi5(以最大吸氢量计)和液态氢的含氢量之比为 。
,则相同体积LaNi5(以最大吸氢量计)和液态氢的含氢量之比为 。
金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2= +2FeS+SO2,(方程式已配平)
+2FeS+SO2,(方程式已配平)
(1)方框中的物质应为_________
(2)若有1 molSO2 生成,则反应中电子转移数目为____ _____
(3)SO2是产物。
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50 mL密度为1.1g∙cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题: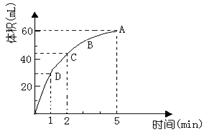
(1)实验时放出气体的总体积为 ___;
(2)放出一半气体所需要的时间为 ______;
(3)ABCD四点化学反应速率的由快到慢顺序为 ___________ ;
(4)在5min后,收集到的气体体积不再增加,原因是。
主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:
⑴A、B、C、D分别是 、 、 、 ;(填元素符号)
⑵D的离子结构示意图为 ,A与B形成的化合物的电子式为 ;
⑶B、C的气态氢化物稳定性由强到弱的顺序为:(写化学式,并用“<”或“>”表示强弱)。
(4)写出一种由A、B、C、D组成的化合物的化学式 。
下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白: 
主族 周期 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
 (1) 在这些元素中,化学性质最不活泼的是: _(填具体元素符号,下同)。
(1) 在这些元素中,化学性质最不活泼的是: _(填具体元素符号,下同)。 (2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的分子式是_____________。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的分子式是_____________。 (3) 最高价氧化物的水化物显两性的是;写出它与盐酸反应的离子方程式。
(3) 最高价氧化物的水化物显两性的是;写出它与盐酸反应的离子方程式。 (4) 表示元素④与⑦形成的化合物的电子式。
(4) 表示元素④与⑦形成的化合物的电子式。 (5)表示元素①与③形成的化合物的电子式。
(5)表示元素①与③形成的化合物的电子式。
工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下: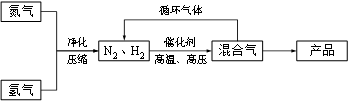
回答下列问题:
(1)已知: N2(g) + O2(g) 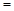 2NO(g)ΔH
2NO(g)ΔH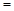 +180.5kJ/mol
+180.5kJ/mol
4NH3(g) + 5O2(g) 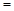 4NO(g) + 6H2O(g)ΔH
4NO(g) + 6H2O(g)ΔH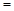 −905kJ/mol
−905kJ/mol
2H2(g) + O2(g) 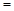 2H2O(g)ΔH
2H2O(g)ΔH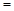 −483.6kJ/mol
−483.6kJ/mol
则N2(g) + 3H2(g) ≒ 2NH3(g)ΔH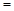 ________________。
________________。
(2)如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强②增大反应物的浓度③使用催化剂④降低温度
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤②蒸馏③渗析④萃取
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5)假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。