(12分)如下图所示,在容器A中装有20 ℃的水50 mL,容器B中装有1 mol/L的盐酸50 mL,试管C、D相连通。其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2N2O4 ΔH=-57 kJ/mol;当向A中加入50 g NH4NO3晶体使之溶解;向B中加入2 g苛性钠时: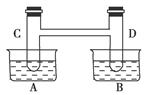
(1)C中的气体颜色______;D中的气体颜色______。
(2)25 ℃时,2NO2N2O4达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=0.032 1 mol/L,则NO2的起始浓度为__________,NO2的转化率为______。
氨气是生产化肥、硝酸的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g)ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g)ΔH =" -92.4" kJ/mol
2NH3 (g)ΔH =" -92.4" kJ/mol
计算断裂1 mol N≡N键需要能量kJ , 氮气分子中化学键比氧气分子中的化学键键(填“强”或“弱”),
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:
3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 |
H2 |
NH3 |
|
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
| 丙 |
0 |
0 |
4 |
①判断乙容器中反应进行的方向。(填“正向”或“逆向”)
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为。
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al的原子结构示意图为;Al与NaOH溶液反应的离子方程式为
。
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为。
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g)△H<0
Si3N4(s) + 12HCl(g)△H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是mol/(L·min)。
②平衡时容器内N2的浓度是mol·L-1。
③SiCl4(g)的转化率是。
④若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应(填“增大”、“减”或“不变”)。
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
有下列几组物质:
A. H和 H和 H H |
| B.甲烷和己烷 |
| C.正丁烷和异丁烷 |
D. 和 和 |
E. 和
和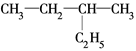
其中,①属于同分异构体的是________;②属于同位素的是________;③属于同一种物质的是________;④属于同系物的是________________。
(一)、将2 mol SO2和1 mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g)  2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=; (2)2s时的O2浓度。
2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=; (2)2s时的O2浓度。
(二)、某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。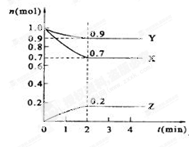
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=;
(4)当反应进行到第min,该反应达到平衡。
同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应,请写出下列反应的化学方程式,并判断其反应类型。
(1)由甲烷制取CH3Cl:_________________________________,属于________反应。
(2)由苯制取硝基苯:__________________________________,属于________反应。
(3)由苯制取环己烷:__________________________________,属于________反应。