已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下图:
回答下列问题:
(1)加入CuO的作用是 。
(2)步骤②中所用的部分仪器如图所示,则A、B分别连直流电源的 和 极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有: 。A极发生的电极反应式为 。
B极发生的电极反应式为_____________________________________。
(4)下列实验操作中必要的是 (填写字母) 。
。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为 (用带有n、V的式子表示)。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下: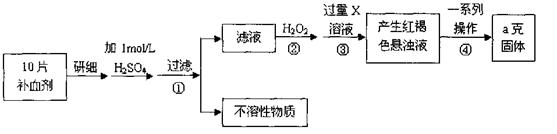
请回答下列问题:
(1)步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有 (填离子符号),检验滤液中还存在Fe2+的方法为
(注明试剂、现象)。
(2)步骤②加入过量H2O2的目的是 。
(3)步骤③中反应的离子方程式为 。
(4)步骤④中一系列处理的操作步骤包括:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量为 g。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。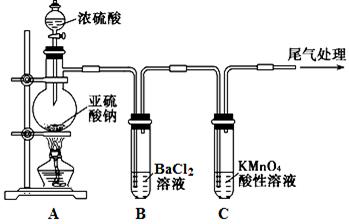
已知:Na2SO3+H2SO4(浓)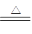 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是。
(2)实验过程中,C中的现象是,说明SO2具有性。
(3)实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验: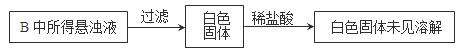
根据实验事实判断该白色沉淀的成分是(填化学式),产生该白色沉淀的原因可能是(填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并明理由。
将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现。这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,然后立即转变为普通氧分子,多余的能量以红光放出。本实验所用的仪器及导管如图。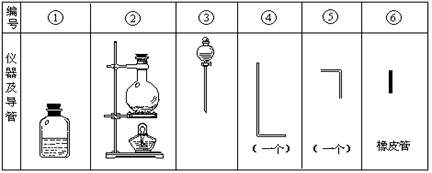
根据要求填写下列空白:
(1)组装氯气发生装置时,应选用的仪器及导管为 (填写图中编号)。
(2)本实验进行时,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次为 。
(3)仪器①的橡皮塞上至少应有2个孔的原因是 。
(4)本实验需配置10mol·L-1的NaOH溶液500mL,用到的仪器除了托盘天平、烧杯外,还须用到的仪器有 (填仪器名称) ,定容时操作如图,则所配溶液浓度 (填“偏高”或“偏低”)。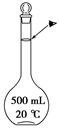
(5)实验时仪器①中ClO-与H2O2反应的离子方程式为 。
某化学兴趣小组的同学利用所示实验装置进行实验(图中a、b、c表示止水夹)。
请按要求填空:
(1)利用B装置可制取的气体有__________(填2种)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
请你评价实验Ⅱ结论是否合理?_____________;理由:______________。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)_____________。
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为____________________________。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是_______________________。
③试管丁中的NO2与一定量的O2混合充满后倒插水中,试管9/10充满水,则原试管丁中的混合气体平均相对分子质量可能为_________。(只填一种即可,保留二位小数)
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。请你协助他们探究所得气体的成分。
Ⅰ【提出猜想】
猜想1:所得气体中可能是SO2。 猜想2:所得气体中可能是__________。
猜想3:所得气体中可能是_______的混合气体。
Ⅱ【实验探究】
(1)将所得气体通入如下装置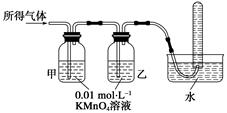
证明猜想3正确的实验现象是___________、______________、________________。
(2)点燃余下的气体前,必须要进行的操作是_________________________________。
(3)写出浓硫酸表现出强氧化性的化学反应方程式_____________________________。
(4)如果把一定量的铁与浓硫酸加热时产生的气体通过装有过量Na2O2粉末的玻璃管,则玻璃管中反应的生成物可能含有(填化学式)__________________ ___________ _。