Ⅰ、某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)
(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯,Cl-移向______烧杯(填“A”或“B”),装置中电子的移动路径和方向为___________________________。
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(2)该小组的一位成员认为溶液中的阴阳离子能通过铜导线从而构成闭合回路形成电流,该装置仍然为原电池。你对该观点的评价是__________(填“正确”或“不正确”)。
(3)对于实验中产生电流的原因,该小组进了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池。那么在烧杯B中铜片上发生反应的电极反应式为______________________。
(4)对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的电极反应式为:
正极:_________________________________。
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的电极反应式为:
正极:_________________________________。
(5)若第(4)问中②观点正确,则可以利用此原理设计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式
____________________________________________________________________。
混合物A中含有KAl(SO4)2·12H2O、Al2O3和Fe2O3,通过下图所示方法可分离回收Al2O3和Fe2O3:
回答下列问题:
(1) 滤渣Ⅰ的主要成分是(填化学式)。
(2) 为了使滤渣Ⅰ中某些成分溶解,便于分离出Fe2O3,所加入的试剂Ⅰ是(填化学式),发生反应的离子方程式是:。
(3) 向滤液Ⅰ中加入过量氨水可得到白色沉淀,反应的离子方程式是:。
(4) 滤渣Ⅲ的主要成分是(填化学式);滤渣Ⅲ在一定条件下反应生成 Al2O3,反应的化学方程式是。
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。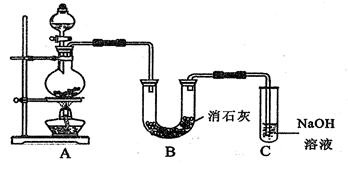
据此回答下列问题:
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,若在标准状态下收集到33.6L的氯气,则被氧化的HCl的物质的量是。
(2) 漂白粉将在U形管中产生,其化学方程式是。
(3) C装置的作用是。
(4) 此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U
形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措
施是。
② 试判断另一个副反应为(用化学方程式表示)。
为避免此副反应的发生,可将装置作何改进。
(5) 家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是( )
| A.食盐 | B.食醋 | C.烧碱 | D.纯碱 |
氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
。
实验室用Na2CO3固体配制250 mL 0.1 mol/L的Na2CO3溶液。请填写下列空白:
(1)实验时,应用托盘天平称取Na2CO3固体g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、、
。
(3)实验中两次用到玻璃棒,其作用分别是___________、__________。
(4)若实验过程中遇到下列情况,则会造成所配溶液浓度偏低的有_____。(填序号)
| A.转移前,容量瓶中含有少量蒸馏水 |
| B.转移时,有少量溶液溅出 |
| C.定容时,仰视刻度线 |
| D.定容时,俯视刻度线 |
某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为; C中反应的离子方程式为
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是
(3)试验中发现Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g产品,配成100ml溶液,移取25.00ml溶液,用0.20mol/L酸性KMnO4溶液进行滴定,消耗KMnO4溶液20.00mL,产品中Na2SO3质量分数的计算表达式为,计算结果为。(保留两位小数)