现用盐酸标准溶液来测定NaOH溶液的浓度。滴定时有下列操作:
①向溶液中加入1~2滴指示剂。
②取20.00 mL标准溶液放入锥形瓶中。
③用氢氧化钠溶液滴定至终点。
④重复以上操作。
⑤配制250 mL盐酸标准溶液。
⑥根据实验数据计算氢氧化钠的物质的量浓度。
(1)以上各步中,正确的操作顺序是________________________________(填序号),上述②中使用的仪器除锥形瓶外,还需要_____________,使用________作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如下表:
| 滴定次数 |
1 |
2 |
3 |
4 |
| V(标准溶液)/mL |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)/mL(初读数) |
0.10 |
0.30 |
0.00 |
0.20 |
| V(NaOH)/mL(终读数) |
20.08 |
20.30 |
20.80 |
20.22 |
| V(NaOH)/mL(消耗) |
19.98 |
20.00 |
20.80 |
20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为
V(NaOH) =  mL =" 20.02" mL
mL =" 20.02" mL
他的计算合理吗? 。理由是 。
通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如下图所示,则a 20.02(填“>”“<”或“=”)。
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下:镁条、铝条、铝粉、钠、新制的Na2S溶液、新制的氯水、0.5mol/L的盐酸、3mol/L的盐酸、酚酞试液,其设计的实验方案及部分实验现象如下表:
| 实验步骤 |
实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 |
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 |
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 |
|
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 |
剧烈反应产生气体,但铝粉消失比镁条快 |
请回答下列问题:
(1)实验③的现象是,该反应的离子方程式为,
(2)由实验③得出的实验结论是
(3)由实验②可得出决定化学反应快慢的主要因素是
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确?(填是或否)
(5)通过实验④说明要加快化学反应速率可或。
某研究性学习小组为确定某纯净碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是__________;A处U形管盛放的药品是__________________,其作用为_______________________。
(2)指导老师在审阅设计方案后指出需要在E处增加一装置,你认为该装置应该是_____________________________.
(3)加热前需要向该装置缓缓鼓入空气数分钟,其目的是___________________;此时对活塞的操作方法是:打开活塞____________________,关闭活塞_________________。
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于_________________________。
(5)反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是_____________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式______________________,该碱式碳酸镁受热分解的化学方程式为____________。
(共18分)某化学兴趣小组在加热下利用二氧化锰与浓盐酸反应来制取并收集氯气。
(1)制取氯气时在烧瓶中加入一定量的二氧化锰,通过(填仪器名称)向烧瓶中加入适量的浓盐酸,写出该反应的化学方程式。
(2)这种装置制取得到的氯气中可能含有少量气体和气体,若要得到纯净干燥的氯气,应使气体依次通过装有和的洗气瓶。
(3)上述反应中,氧化剂是
(4)反应结束后还可能有少量的氯气,为了防止污染空气,必须把尾气通入中,写出反应的离子方程式
(5)该小组若用200mL 10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为0.5mol(填“大于”、“等于”或“小于”),原因是。
(6)87g二氧化锰与足量的浓盐酸反应,问生成的氯气在标况的体积为多少?参加反应的盐酸中被氧化的那部分的物质的量是多少?(相对原子质量:Mn—55 O—16 要求写出计算格式)
实验室用如图所示的装置制取乙酸乙酯.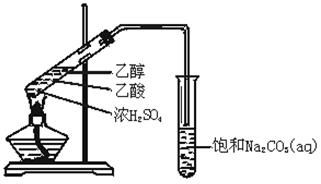
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是:,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸.造成倒吸的操作上的原因是_______________________________。
(3)浓硫酸的作用是①___________; ②___________.
(4)饱和Na2CO3溶液的作用是_______________;_________________;
_____________________________。
(5)生成的乙酸乙酯的化学方程式,乙酸乙酯的密度比水________(填“大”或“小”),有_________味.
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题: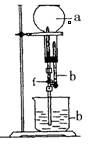
(1)写出实验室制取氨气的化学方程式。
(2)要得到干燥的氨气可选用作干燥剂。
| A.碱石灰(CaO和NaOH的混合物) | B.浓硫酸 |
| C.浓硝酸 | D.氢氧化钠溶液 |
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是
___________________________________________.。