某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下:镁条、铝条、铝粉、钠、新制的Na2S溶液、新制的氯水、0.5mol/L的盐酸、3mol/L的盐酸、酚酞试液,其设计的实验方案及部分实验现象如下表:
| 实验步骤 |
实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 |
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 |
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 |
|
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 |
剧烈反应产生气体,但铝粉消失比镁条快 |
请回答下列问题:
(1)实验③的现象是 ,该反应的离子方程式为 ,
(2)由实验③得出的实验结论是
(3)由实验②可得出决定化学反应快慢的主要因素是
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确? (填是或否)
(5)通过实验④说明要加快化学反应速率可 或 。
为了保护坏境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(Fe主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略).
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 .
(2)检验第Ⅱ步中Fe3+是否完全被还原,应选择 (填字母编号).
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%,将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3 kg.
硫酸亚铁晶体(FeSO4•7H2O)在医药上常作补血剂,某课外研究小组测定该补血剂中铁元素的含量,其实验步骤如下:
请回答下列问题:
(1)证明操作Ⅰ滤液中含有Fe2+的方法之一是向滤液中加入NaOH溶液,现象为 ,步骤Ⅱ中发生反应的离子方程式为 .
(2)写出步骤Ⅳ中一系列处理的操作步骤:过滤、 、灼烧、 、称量.
(3)若实验无损耗,则每片补血剂中含铁元素 g.
(4)该小组有些同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定.
①该实验原理用离子方程式可表示为 .
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 .
③该实验中的KMnO4溶液需要酸化,用于酸化的酸是 .
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
④若取m g该补血剂用0.1mol•L﹣1的KMnO4溶液进行滴定,在此实验过程中共用去KMnO4溶液100mL,则该补血剂中铁元素的质量分数为 .
已知:CH3CH2OH+NaBr+H2SO4(浓) CH3CH2Br+NaHSO4+H2O.
CH3CH2Br+NaHSO4+H2O.
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下: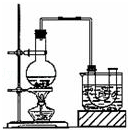
①按图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应.
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为 .
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是 .
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色.将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取 (填“上层”或“下层”)液体.为了除去其中的杂质,可选择下列试剂中的 (填序号).
| A.Na2SO3溶液 | B.H2O | C.NaOH溶液 | D.CCl4 |
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行 (填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后 (填序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却.
某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
| 2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
| 4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式 .
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是 .
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(写出2种可能):
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃).请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量):
| 实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L﹣1 |
| 1 实验①和②探究盐酸浓度对该反应速率的影响; 2实验①和③探究温度对该反应速率的影响; 3实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① |
25˚C |
铝片 |
4.0 |
| ② |
||||
| ③ |
||||
| ④ |
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、KCl等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解.
试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 .
(2)写出实验③中的离子方程式: .
(3)对可能有的物质进行确认,把③的滤液做进一步鉴别操作,写出你所设计的实验方案(包括具体操作步骤和实验现象) .