为了保护坏境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(Fe主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略).

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 .
(2)检验第Ⅱ步中Fe3+是否完全被还原,应选择 (填字母编号).
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:
4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%,将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3 kg.
用下图装置进行实验。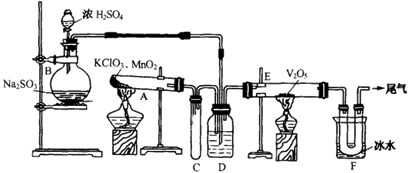
回答有关问题:
(1)玻璃管E内发生反应的化学方程式是。
(2)小试管C的作用是。
(3)广口瓶D内盛的试剂是,装置D的3个作用是①, ②, ③。
(4)从管E导出的气体成分是。
(5)装置F中U形管观察到所收集物质的颜色状态是。
(6)若U形管内收集到的物质很少,分析其原因不可能是(填标号)。
a.装置气密性不好; b.制得的SO2中混有少量H2S杂质使催化剂中毒;c.气流速度过快。
(7)从U形管导出的尾气的处理方法是。
某研究性学习小组拟探究在含Mg2+、Al3+ 的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
【实验】在0.1 mol∙L-1 MgSO4、0.05 mol∙L-1Al2(SO4)3的混合溶液中滴加0.5 mol∙L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。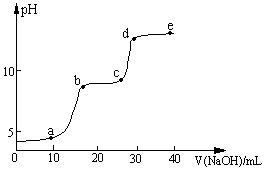
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于(填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2:;
推测3:。
若推测1符合实际情况,则a点之前反应的离子方程式为,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
| 较大量存在的含金属元素的离子 |
检验方法 |
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)为了确定产物,进行以下定性实验:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
安静燃烧, 火焰呈淡蓝色 |
气体成分为 ① |
| 实验Ⅲ |
将实验I中的白色不溶物滤出、洗涤,取少量加入足量② |
③ |
白色不溶物中含有MgCO3 |
| 实验Ⅳ |
取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 |
产生白色沉淀,溶液红色变浅 |
溶液中存在CO32- 离子 |
实验Ⅲ中洗涤的操作方法是。
(3)为进一步确定实验I的白色不溶物的成分,进行以下定量实验,装置如图所示:
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
装置C的作用是;
白色不溶物的化学式为 。
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式。
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为。
研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应
方案二:检验溶液中含有证明发生了氧化还原反应
实验用品:0.1mol/L BaCl2、3mol/L盐酸、0.1mol/LKMnO4(H+)、氯水、20%KSCN、0.5mol/LKI;试管若干、胶头滴管若干
Ⅰ预处理:将(1)中获得的混合物放在如图装置中处理足够时间。
Ⅱ检验过程
| 操作 |
现象及结论 |
| 基于方案一: |
|
| 基于方案二: |
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为________;仪器b中可选择的试剂为________;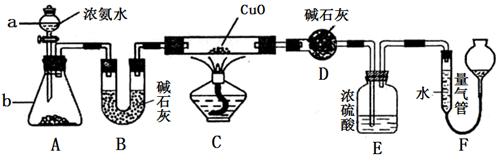
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是()
| A.Cl2与饱和食盐水 | B.CO2 与40%的NaOH溶液 |
| C.NH3与饱和食盐水 | D.HCl与水 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有还原性,写出相应的化学方程式______________________________ .
(4)E装置中浓硫酸的作用_______________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)