[物质结构与性质] 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍。X原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为_______________。
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为_____________,根据价层电子对互斥理论预测BA2D的分子构型为____________。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-。与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上。根据其结构特点可知该晶体的化学式为(用最简正整数表示)________
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体
结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
根据表格中的数据:判断KCl、MgO、TiN 三种离子晶体熔点从高到低的顺序是______________。MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有__________________个。
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是__________________。
在一定条件下,用乙烷和乙烯制备氯乙烷(CH3CH2Cl),试回答:
(1)用乙烷制备氯乙烷的化学方程式是
反应类型是。
(2)用乙烯制备氯乙烷的化学方程式是
反应类型是。
(3)比较上述两种方法,第种方法好,其原因是
燃料电池是目前正在探索的一种新型电池。它的工作原理是在燃料燃烧过程中将化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是:X极:O2(g) + 4e- + 2H2O(l) ="==" 4OH-
Y极:H2(g)-2e- + 2OH- ="==" 2H2O(l)
(1)X极是电池的极(“正”或“负” ),发生反应(“氧化”或“还原” )反应。
(2)总的电池反应方程式
(3)若反应得到5.4g液态水,燃料电池中转移的电子为mol
【有机化学基础】
莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下: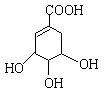
(1)A分子中两种含氧官能团的名称是 。
(2)1mol A与氢氧化钠溶液完全反应,需要消耗NaOH的物质的量是。
(3)A在浓硫酸作用下加热可得到B(B的结构简式为 ),其反应类型是。
),其反应类型是。
(4)B的同分异构体中既含有酚羟基又含有酯基的共有种,写出其中一种同分异构体的结构简式
(5)A与CH3CH218OH在浓硫酸加热条件下发生酯化反应的化学方程式
【物质结构与性质】
(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如下表所示:
| X |
Y |
Z |
|
| I1 |
496 |
738 |
577 |
| I2 |
4562 |
1451 |
1817 |
| I3 |
6912 |
7733 |
2754 |
| 9540 |
10540 |
11578 |
①三种元素电负性大小关系为_______________
②写出Y原子的电子排布式_____________ Y的第一电离能大于Z的第一电离能的原因_______________________
③X晶体采用下列_________(填字母)堆积方式。


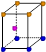
A B C D
(2)N2O的等电子体为:①分子______________,②阴离子______________;由此可知N2O的中心原子的杂化类型为_____________。根据价层电子对互斥模型确定NO2的分子构型为:_____________________________________。
(3)已知铜能形成多种化合物,如硫酸铜的结构如下图所示,
请在图中标出水合铜离子中的配位键.
I、下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法。填表(填入序号):
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液。
C:(1)变性;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气。
| 物质 |
加入试剂 |
操作方法 |
| ①苯(苯甲酸) |
||
| ②乙酸乙酯(乙醇) |
II、1 mol 与足量的NaOH溶液充分反应,消耗
与足量的NaOH溶液充分反应,消耗
NaOH的物质的量为mol