[有机化学基础] 有机物A的结构简式为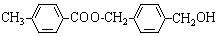 ,从A出发,可发生图示中的一系列反应。其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志。
,从A出发,可发生图示中的一系列反应。其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志。
已知:
④甲醛分子中4个原子共平面。
请回答下列问题:
(1)写出A中含有的官能团的名称________________________
(2)写出下列物质的结构简式:J____________;F__________________。
(3)写出下列反应的化学方程式(注明反应条件并配平)
H→M________________________;D+I→K_____________________。
(4)与B互为同分异构体,属于酯类且含有苯环的化合物有_____种。
(5)C分子中处于同一平面的原子最多可有__________个。
火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.8、0.20),主要反应为:
焙烧炉中:2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2(g)①
鼓风炉中:2C(s) + O2(g) →2CO②
鼓风炉中:ZnO(s) + CO(g) Zn(g)+CO2(g)③
Zn(g)+CO2(g)③
(1)已知闪锌矿中含硫16%(其它杂质不含硫),则闪锌矿中硫化锌的含量为。
(2)焙烧炉产生的炉气中SO2的体积分数不超过%(保留小数后一位数字)。
⑶鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
| 时间/min |
CO |
Zn |
CO2 |
| 0 |
0.11 |
0 |
0 |
| 2 |
0.10 |
0.01 |
0.01 |
| 3 |
0.01 |
0.10 |
0.10 |
| 4 |
0.01 |
0.10 |
0.10 |
则鼓风炉中CO总的转化率为;若生产中CO总的利用率为95%,则每生产1molZn,至少需要补充焦炭g。
⑷若ZnS全部转化为Zn。焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,则每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共L(S.T.P)。
白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为____________g/mo1。
(2)另取4.05g白玉粉末加入lmol/L的盐酸l00mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则
①p=_______;②白玉的化学式为______________________________。
(13分)已知: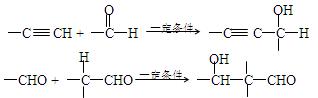
以乙炔为原料,通过下图所示步骤能合成有机物中间体E(转化过程中的反应条件及部分产物已略去)。
其中,A、B、C、D分别代表一种有机物;B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1)A→B的化学反应类型是。
(2)写出生成A的化学方程式: 。
。
(3)B在浓硫酸催化下加热,可生成多种有机物。写出2种相对分子质量比A小的有机物的结构简式:
、。
(4)写出C生成D的化学方程式:。
(5)含有苯环,且与E互为同分异构体的酯有种,写出其中二种同分异构体的结构简式:。
有机物A,俗称水杨酸,其结构简式为:
已知:
(1)将A跟下列物质的溶液反应可以得到一种钠盐(其化学式为C7H5O3Na)是
。
A.NaOH B.Na2CO3 C.NaHCO3 D.NaCl
(2)水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有种,其结构简式分别为。
(3)水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物一定含有基(填写除了羟基以外的官能团名称)
(4)水杨酸在酸性条件下与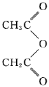 反应合成阿司匹林,则阿司匹林的结构为。可以检验阿司匹林样品中混有水杨酸的试剂是。
反应合成阿司匹林,则阿司匹林的结构为。可以检验阿司匹林样品中混有水杨酸的试剂是。
A.三氯化铁溶液 B.碳酸氢钠 C.石蕊试液
工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。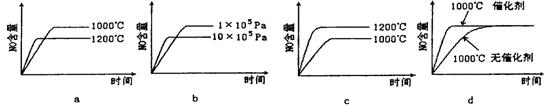
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是_________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。