【化学-有机化学基础】
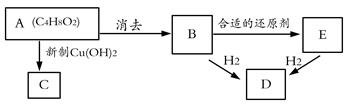
下图中,A无酸性,不能水解,在一定条件下发生消去反应可得到两种互为同分异构体的产物,其中的一种B含有一个甲基,可用于制取合成树脂、染料等多种化工产品。E能使溴水退色,不能发生银镜反应。
|
试回答下列问题;
某混合物由NaCl、MgCl2、AlCl3三种物质组成,已知Na、Mg、Al三种元素的质量比为23∶16∶9,则NaCl、MgCl2、AlCl3三种物质的物质的量比为 ,当Cl-为1 mol时,混合物的质量是 g。
FeO、Fe2O3、Fe3O4三种纯的氧化物中,与等量铁原子相结合的氧原子的质量比为,与等量氧原子相结合的铁原子的物质的量之比为 。
将一种化学式为R(NO3)x·nH2O的硝酸盐晶体6.05 g溶于水配成500 mL溶液,用石墨棒作为电极材料对此溶液进行电解。当通过电流强度为5 A的电流16.05 min时,溶液中的金属离子已全部放电,且其中一电极增重1.60 g(已知此晶体的摩尔质量为242 g·mol-1)。
则:①x=____________,②R的相对原子质量为____________,③n=____________。
已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的相对分子质量比Z小16,乙与丙的相对分子质量相同,B的相对分子质量比D的小2,B与X的相对分子质量相同,各物质转化关系如右图(各反应条件已略去)。
(1)丙和B的化学式分别为__________________和__________________。
(2)Y转化为Z的化学方程式为__________________________________。
(3)B与D反应的化学方程式为__________________________________。
现有一重水(D2O)和水(H2O)的混合物(不是天然的纯水)。当m g这种水被电解时,电路上通过x mol电子,阳极收集到气体m1 g,阴极收集到气体m2 g(电解产物的溶解忽略不计)。
(1)若要求出重水的质量分数y,至少需要上述m、x、m1、m2等4个数据中的_______个。这些数据共有_____组,在下列橫线上分别列出(有多少填多少)____________________。
(2)从(1)中空格所填的数据中任取一组含m的数据,计算已被电解的水中D2O的质量分数y=_______。