(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
| 实验编号 |
0.01mol·L-1 酸性KMnO4溶液 |
0.1mol·L-1 H2C2O4溶液 |
水 |
1mol·L-1 MnSO4溶液 |
反应温度 /℃ |
反应时间 |
| I |
2mL |
2mL |
0 |
0 |
20 |
125 |
| II |
____mL |
____mL |
1mL |
0 |
20 |
320 |
| III |
____mL |
___mL |
___mL |
0 |
50 |
30 |
| IV |
2mL |
2mL |
0 |
2滴 |
20 |
10 |
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至________时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 +H2C2O4 + H2SO4=K2SO4 + MnSO4 + CO2↑+ H2O
低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)该反应逆反应的化学平衡常数表达式为K =。
(2)上述正反应方向是反应(填“放热”或“吸热”)。
(3)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=mol·L-1·min-1。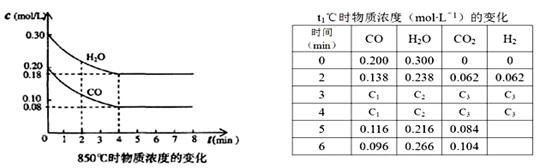
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3 min~4 min之间反应处于状态;C1数值0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是(单选),表中5 min~6 min之间数值发生变化,可能的原因是(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为:。
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: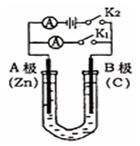
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是,Na+移向极(填A、B);B电极上的电极反应式为,总反应化学方程式是 。
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会(填“增大”、“减小”、“不变”)。
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为:。
(2)今有如下两个热化学方程式:则ab(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g)ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l)ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)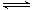 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ;
CH3OCH3(g) + CO2 (g)的ΔH= ;
(每空2分,共12分)实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案: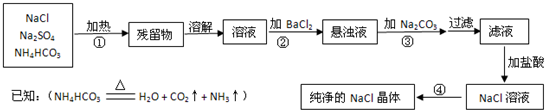
请回答下列问题:
(1)操作①加热的目的是______,发生的反应______(填“是”或“不是”)氧化还原反应.
(2)操作②除用BaCl2溶液外,还可以用______.
(3)操作③的目的是_____,发生反应的方程式为:.
(4)操作④应在(填仪器名称)中进行.