(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
| 实验编号 |
0.01mol·L-1 酸性KMnO4溶液 |
0.1mol·L-1 H2C2O4溶液 |
水 |
1mol·L-1 MnSO4溶液 |
反应温度 /℃ |
反应时间 |
| I |
2mL |
2mL |
0 |
0 |
20 |
125 |
| II |
____mL |
____mL |
1mL |
0 |
20 |
320 |
| III |
____mL |
___mL |
___mL |
0 |
50 |
30 |
| IV |
2mL |
2mL |
0 |
2滴 |
20 |
10 |
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至___ ___ __时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 + H2C2O4 + H2SO4= K2SO4 + MnSO4 + CO2↑+ H2O
近年来,随着人们对化石能源大量的开发使用,不但使得煤、石油、天然气的储量大大减少,而且直接燃烧化石燃料造成的环境污染问题,也是人类面临的重大挑战,如何实现化石燃料的综合利用,提高效率,减少污染被提上了日程。为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:
2H2(g)+CO(g)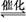 CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
| t/s |
0 |
500 |
1 000 |
| c(H2)/(mol·L-1) |
5.00 |
3.52 |
2.48 |
| c(CO)/(mol·L-1) |
2.50 |
(1)在500 s内用H2表示的化学反应速率是 。
(2)在1 000 s内用CO表示的化学反应速率是 ,1 000 s时CO的转化率是 。
(3)在500 s时生成的甲醇的浓度是 。
在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
| 物质 时间 |
X |
Y |
Z |
Q |
| 起始/mol |
0.7 |
1 |
||
| 2 min末/mol |
0.8 |
2.7 |
0.8 |
2.7 |
| 3 min末/mol |
0.8 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,,
(1)试确定以下物质的相关量:
起始时n(Y)= ,n(Q)= 。
(2)方程式中m= ,n= ,p= ,q= 。
(3)用Z表示2 min内的反应速率 。
某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得: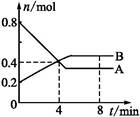
(1)在4 min末时,A、B的物质的量浓度c(A) c(B);从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 。
(2)已知H2O(l) H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7 kJ·mol-1
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
肼和二氧化氮反应的热化学方程式为 。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向煤气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达12 500~16 000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。已知:
C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1①
CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g) 2H2O(g) ΔH2=-483.6 kJ·mol-1②
2H2O(g) ΔH2=-483.6 kJ·mol-1②
C(s)+H2O(g) CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。