将等物质的量的X.Y气体充入一容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)+2M(s)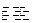 2Z(g);
2Z(g);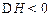 。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是 ( )
。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是 ( )
| |
改变的条件 |
正.逆反应速率变化 |
新平衡与原平衡比较 |
| A |
升高温度 |
逆反应速率增大量大于正反应速率增大量 |
X的体积分数增大 |
| B |
增大压强 |
正反应速率增大,逆反应速率减小 |
Z的浓度不变 |
| C |
减小压强 |
正.逆反应速率都减小 |
Y的体积分数变大 |
| D |
充入一定量的Z |
逆反应速率增大 |
X的体积分数变大 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 molCl2参加反应转移电子数一定为2NA |
| B.标准状况下,2.24 L乙醇分子所含的C-H键数为 0.5NA |
| C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| D.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA |
下列有关物质性质和该性质的应用均正确的是
| A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
| B.K2FeO4具有还原性,可用于自来水的杀菌消毒 |
| C.二氧化硫和氯水均具有漂白性,可将两者混合使用增强漂白效果 |
| D.Fe3+具有氧化性,可溶解印刷线路板上的金属铜 |
中学化学教材中有大量数据,下列是某同学对数据的利用情况,其中正确的是
| A.利用焓变的数据或熵变的数据一定都能单独判断反应是否能自发进行 |
| B.利用反应热数据的大小判断不同反应的反应速率的大小 |
| C.利用沸点数据推测将一些液体混合物分离开来的可能性 |
| D.利用溶液的pH与7的大小关系,判断PH=6.8的溶液一定显酸性 |
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A.0.1(b-2a)mol/L | B.10( 2a-b)mol/L | C.10(b-a)mol/L | D.10(b-2a)mol/L |
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 |
a+b |
c+d |
a+d |
a+c |
b+d |
| 现象 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无色气体 |
由上述现象可推知a、b、c、d依次是()
A.HCl、BaCl2、AgNO3、Na2CO3B.AgNO3、HCl、Na2CO3、BaCl2
C.AgNO3、HCl、BaCl2、Na2CO3D.BaCl2、Na2CO3、 AgNO3、HCl