A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题: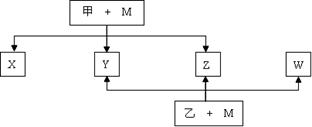
(1)写出M与甲的浓溶液加热时反应的化学方程式 。
(2)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n= ,写出反应的化学方程式 。
(4)化合物ED2与元素B形成的某种单质晶体类型相同,且在高温下能发生置换反应。若反应中B的单质被破坏1 mol共价键,则参加反应的化合物ED2的质量为 g。
(5)元素B的另一种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12 g该晶体中含有 NA个正六边形。
实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制取氯气。
(1)请标出电子的转移方向和数目
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl2 11.2L,则反应过程中转移的电子数为________,被氧化的还原剂
的物质的量为___________。
(3)需消耗36.5%的浓盐酸多少质量?
有一固体混合物,可能由NaI、KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成;
③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成。
④往滤液中加入足量的新制的氯水,再加入少许汽油,振荡,静置,上层液体呈紫红色。
(1)试判断:固体混合物中肯定含有,一定没有,可能含有________________。
(2)对可能含有的物质,如何进行实验以进一步检验。。
(3)实验④中发生的化学反应属于反应(填反应类型),主要实验操作名称叫。
按要求填空:
(1)以下物质:①NH3②CaCO3③酒精④饱和食盐水⑤Cu⑥KOH⑦HCl属于电解质的有(填编号);
(2)14.7gH2SO4分子所含氢原子数与 L (标准状况下)NH3所含氢原子数相等;
(3)固体NaCl(I2)(括号内的物质为杂质),除去杂质的方法为。
(4)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
| A.蒸发结晶 | B.过滤 | C.加入过量的Na2CO3溶液 | D.加水溶解 E、加入过量的烧碱溶液 F、加入过量稀盐酸 G、加入过量的Ba(NO3)2溶液 H、加入过量的稀硝酸 I、加入过量的BaCl2溶液 |
正确的操作顺序是:→ E →→ C → → → A
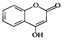 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成。
 请回答下列问题:
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(2)B→C的反应类型是;E的结构简式是。
(3)F和过量NaOH溶液共热时反应的化学方程式 为。
为。 (4)下列关于G的说法正确的是。
(4)下列关于G的说法正确的是。 a.能与溴单质反应 b.能与金属钠反应
a.能与溴单质反应 b.能与金属钠反应 c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
(5)与D互为同分异构体且含酚羟基、属于酯类的有 种
种
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断:段化学反应速率最快,段收集的二氧化碳最多。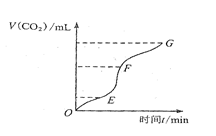
(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是()
| A.蒸馏水 | B.NaCl固体 | C.NaCl溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?